Sprawdzian Z Chemii Wodorotlenki Grupa A B C D

Rozumiemy doskonale, że sprawdzian z chemii, a w szczególności ten dotyczący wodorotlenków, może być dla wielu uczniów źródłem stresu i niepewności. Często widzimy uczniów zmagających się z trudnościami w zapamiętywaniu wzorów, rozumieniu reakcji chemicznych czy poprawnego nazywania związków. To zupełnie normalne! Chemia, choć fascynująca, bywa wymagająca. Dlatego też, przygotowaliśmy dla Was materiał, który ma na celu ułatwić zrozumienie tematu wodorotlenków i pomóc Wam poczuć się pewniej przed nadchodzącym sprawdzianem, niezależnie od tego, czy traficie na wersję A, B, C czy D.
Zrozumieć Wodorotlenki: Fundamenty Sukcesu
Co to właściwie są wodorotlenki?
Zacznijmy od podstaw. Wodorotlenki to grupa związków chemicznych, które mają bardzo charakterystyczną budowę. Najprościej mówiąc, są to związki powstałe z połączenia jonu wodorotlenkowego (OH⁻) z kationem metalu. Ten ostatni element jest kluczowy – to obecność metalu odróżnia wodorotlenki od innych grup związków. Pomyślcie o nich jak o "rodzinie" związków, gdzie OH⁻ jest wspólnym członkiem rodziny, a metale to różni "rodzice", którzy nadają każdej substancji unikalne właściwości.
Podstawowe typy wodorotlenków
Wodorotlenki można podzielić na kilka głównych grup, co ułatwia ich klasyfikację i naukę. Najważniejsze z nich to:
- Wodorotlenki rozpuszczalne w wodzie (zasady): To grupa, którą prawdopodobnie najczęściej spotkacie. Należą do nich wodorotlenki metali z grup 1 (metale alkaliczne, np. NaOH – wodorotlenek sodu) i 2 (metale ziem alkalicznych, np. Ca(OH)₂ – wodorotlenek wapnia). Charakteryzują się zasadowym odczynem, co można sprawdzić za pomocą wskaźników, np. papierka lakmusowego czy fenoloftaleiny.
- Wodorotlenki nierozpuszczalne w wodzie: Te wodorotlenki nie tworzą roztworów w wodzie, a osadzają się na dnie naczynia. Występują zazwyczaj w postaci osadów o różnej barwie. Przykładem jest Fe(OH)₃ – wodorotlenek żelaza(III), który ma charakterystyczny czerwonawo-brązowy kolor.
- Wodorotlenki amfoteryczne: To ciekawa kategoria! Są to wodorotlenki, które mogą wykazywać właściwości zarówno kwasowe, jak i zasadowe, w zależności od warunków reakcji. Najczęściej spotykanymi przykładami są wodorotlenki cynku (Zn(OH)₂), glinu (Al(OH)₃) czy chromu (Cr(OH)₃).
Zrozumienie tych podstawowych podziałów to pierwszy, bardzo ważny krok do sukcesu. Pozwala to na uporządkowanie wiedzy i łatwiejsze zapamiętywanie cech poszczególnych grup.
Nazywanie i Wzory Wodorotlenków: Klucz do Precyzji
Systematyczne nazewnictwo
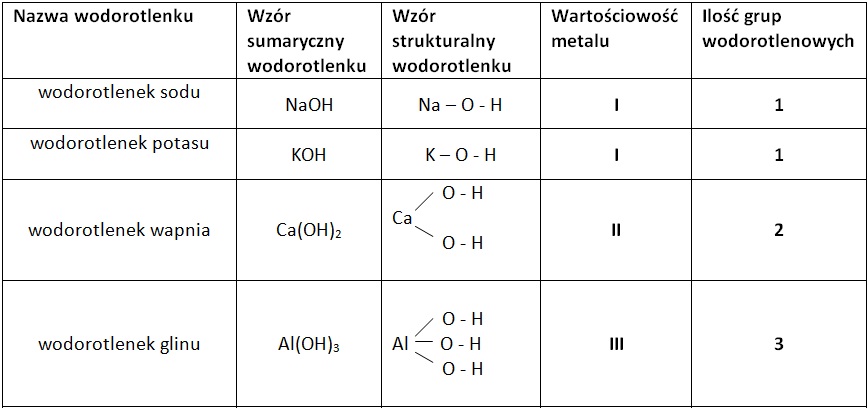
Jedną z największych przeszkód dla wielu uczniów jest poprawne nazywanie wodorotlenków. Tutaj kluczowe jest zrozumienie stopnia utlenienia metalu. Wodorotlenki tworzą metale o różnych stopniach utlenienia. Na przykład:
- NaOH – wodorotlenek sodu (sód ma stopień utlenienia +I)
- Cu(OH)₂ – wodorotlenek miedzi(II) (miedź ma stopień utlenienia +II)
- Fe(OH)₂ – wodorotlenek żelaza(II) (żelazo ma stopień utlenienia +II)
- Fe(OH)₃ – wodorotlenek żelaza(III) (żelazo ma stopień utlenienia +III)
Zwróćcie uwagę na cyfrę rzymską w nawiasie – to właśnie ona informuje nas o stopniu utlenienia metalu i jest niezbędna do poprawnego nazwania związku. Jeśli metal ma tylko jeden możliwy stopień utlenienia (jak większość metali z grupy 1), nazwa jest prostsza. Problemy pojawiają się, gdy metal może występować na więcej niż jednym stopniu utlenienia (np. żelazo, miedź, chrom).
Tworzenie wzorów
Tworzenie wzorów wodorotlenków wymaga zastosowania zasady równowagi ładunków. Pamiętajcie, że jon wodorotlenkowy (OH⁻) ma ładunek -1. Aby związek był elektrycznie obojętny, suma ładunków dodatnich od kationu metalu i ładunków ujemnych od jonów OH⁻ musi wynosić zero. Przykłady:
- Wodorotlenek wapnia: Wapń (Ca) w związkach zazwyczaj występuje na +II stopniu utlenienia. Potrzebujemy więc dwóch jonów OH⁻ (każdy z ładunkiem -1), aby zrównoważyć ładunek Ca²⁺. Stąd wzór: Ca(OH)₂. Nawias jest tu bardzo ważny, ponieważ grupa OH jest traktowana jako całość.
- Wodorotlenek magnezu: Magnez (Mg) również ma stopień utlenienia +II. Podobnie jak w przypadku wapnia, potrzebujemy dwóch jonów OH⁻. Wzór: Mg(OH)₂.
- Wodorotlenek glinu: Glin (Al) ma stopień utlenienia +III. Potrzebujemy więc trzech jonów OH⁻. Wzór: Al(OH)₃.
Praktyczna rada dla uczniów: Zróbcie sobie listę najczęściej występujących metali i ich typowych stopni utlenienia. Ćwiczcie tworzenie wzorów dla każdego z nich. To jak nauka alfabetu – gdy opanujecie podstawy, tworzenie dłuższych słów (czytaj: wzorów) stanie się znacznie łatwiejsze.
Właściwości i Reakcje Wodorotlenków: Kluczowe Zagadnienia na Sprawdzianie
Charakterystyczne właściwości fizyczne
Wodorotlenki często występują w postaci stałej w temperaturze pokojowej. Ich rozpuszczalność w wodzie jest zróżnicowana, co już omówiliśmy. Zasady (rozpuszczalne wodorotlenki) mają często śliską, mydlaną konsystencję i lekko gorzki smak (nigdy nie próbujcie! To dla bezpieczeństwa). Wodorotlenki nierozpuszczalne zazwyczaj tworzą kolorowe osady, które są ważnym elementem identyfikacyjnym w chemii analitycznej.
Najważniejsze reakcje chemiczne
Na sprawdzianie z chemii wodorotlenki pojawią się najprawdopodobniej w kontekście ich reakcji. Oto te, na które warto zwrócić szczególną uwagę:
- Reakcja z kwasami (reakcja zobojętnienia): To jedna z fundamentalnych reakcji wodorotlenków. Zachodzi między zasadą a kwasem, w wyniku czego powstaje sól i woda. Jest to przykład reakcji wymiany.
Przykład: NaOH + HCl → NaCl + H₂O (wodorotlenek sodu reaguje z kwasem solnym, tworząc chlorek sodu i wodę).
Rada dla nauczycieli: Podkreślajcie, że ta reakcja jest kluczowa, ponieważ pozwala na neutralizację kwasów i zasad w różnych procesach przemysłowych i laboratoryjnych. - Reakcje wodorotlenków rozpuszczalnych z kwasowymi tlenkami: Zasady reagują z kwasowymi tlenkami, tworząc sól i wodę.
Przykład: 2NaOH + CO₂ → Na₂CO₃ + H₂O (wodorotlenek sodu reaguje z dwutlenkiem węgla, tworząc węglan sodu i wodę). - Reakcje wodorotlenków nierozpuszczalnych:
- Rozkład termiczny: Wiele wodorotlenków nierozpuszczalnych pod wpływem ogrzewania rozkłada się na odpowiedni tlenek metalu i wodę.
Przykład: Cu(OH)₂ → CuO + H₂O (wodorotlenek miedzi(II) pod wpływem ciepła rozkłada się na tlenek miedzi(II) i wodę). - Reakcje z kwasami: Wodorotlenki nierozpuszczalne reagują z kwasami, tworząc sól i wodę. Jest to reakcja zobojętnienia, podobna do reakcji zasad z kwasami.
Przykład: Fe(OH)₃ + 3HCl → FeCl₃ + 3H₂O (wodorotlenek żelaza(III) reaguje z kwasem solnym, tworząc chlorek żelaza(III) i wodę).
- Rozkład termiczny: Wiele wodorotlenków nierozpuszczalnych pod wpływem ogrzewania rozkłada się na odpowiedni tlenek metalu i wodę.
- Reakcje wodorotlenków amfoterycznych: Jak wspomnieliśmy, reagują one zarówno z mocnymi kwasami, jak i z mocnymi zasadami.
Przykład reakcji z kwasem: Al(OH)₃ + 3HCl → AlCl₃ + 3H₂O.
Przykład reakcji z zasadą: Al(OH)₃ + NaOH + H₂O → Na[Al(OH)₄] (powstaje tetrahydroksoglinian sodu).
Praktyczna rada dla uczniów: Twórzcie schematy reakcji. Zapisujcie, jakie grupy związków reagują ze sobą i jakie produkty powstają. Wykorzystajcie do tego kolorowe fiszki – jeden kolor dla reagentów, inny dla produktów. To nie tylko ułatwia zapamiętanie, ale także wizualizuje procesy chemiczne.
Jak przygotować się do Sprawdzianu A, B, C, D?
Przejrzyj materiały z lekcji
Pierwszym i najważniejszym krokiem jest ponowne przejrzenie notatek z lekcji, podręcznika i ćwiczeń. Zwróćcie uwagę na te fragmenty, które sprawiały Wam największy problem podczas lekcji. Czy były to wzory, nazewnictwo, czy może konkretne reakcje?
Ćwiczenia, ćwiczenia i jeszcze raz ćwiczenia!
Nie ma lepszego sposobu na utrwalenie wiedzy niż rozwiązywanie zadań. Skupcie się na zadaniach z podręcznika, zeszytu ćwiczeń, a jeśli macie taką możliwość, poproście nauczyciela o dodatkowe materiały. Rozwiążcie jak najwięcej przykładów dotyczących:
- Nazywania wodorotlenków.
- Tworzenia wzorów wodorotlenków.
- Bilansowania reakcji z udziałem wodorotlenków.
- Określania typu reakcji (np. zobojętnienia, rozkładu termicznego).
- Identyfikowania wodorotlenków na podstawie ich właściwości (np. koloru osadu, rozpuszczalności).
Praktyczna rada dla nauczycieli: Przygotowując sprawdziany w różnych wersjach (A, B, C, D), starajcie się zachować podobny poziom trudności i zakres materiału. Różnicujcie głównie przykłady i kolejność pytań. To daje uczniom poczucie sprawiedliwości i motywuje do nauki, wiedząc, że każdy materiał jest równie wartościowy.
Zrozumieć, a nie tylko zapamiętywać
Chemia to nie tylko sucha nauka formułek. Ważne jest, aby zrozumieć, dlaczego dany związek ma określony wzór, dlaczego reaguje w określony sposób. Kiedy zaczniecie widzieć powiązania między budową a właściwościami, nauka stanie się znacznie łatwiejsza i przyjemniejsza.
Wsparcie od bliskich
Drodzy rodzice, Wasze wsparcie jest nieocenione! Nie chodzi o to, aby wyręczać dziecko w nauce, ale o stworzenie spokojnej atmosfery, zapewnienie czasu na naukę i wysłuchanie, gdy dziecko ma jakieś pytania czy wątpliwości. Czasem wspólne przeglądanie notatek lub rozmowa o chemii może przynieść zaskakująco pozytywne rezultaty.
Pozytywne nastawienie
I na koniec, ale niezwykle ważne – pozytywne nastawienie! Stres często blokuje nasze możliwości. Uwierzcie w siebie. Każdy z Was ma potencjał, aby zrozumieć chemię. Potraktujcie sprawdzian nie jako wyrok, ale jako możliwość sprawdzenia swojej wiedzy i pokazania, czego się nauczyliście. Nawet jeśli popełnicie jakieś błędy, potraktujcie je jako cenną lekcję na przyszłość.
Pamiętajcie, że opanowanie wodorotlenków to klucz do dalszej nauki chemii. Zrozumienie ich budowy, właściwości i reakcji otwiera drzwi do bardziej zaawansowanych tematów. Jesteśmy pewni, że dzięki systematycznej pracy i zastosowaniu tych praktycznych wskazówek, poradzicie sobie ze sprawdzianem śpiewająco. Powodzenia!