Sprawdzian Z Chemii Weglowodory Chomikuj

Witajcie, młodzi chemicy i przyszli eksperci od cząsteczek! Zbliża się nieuniknione – sprawdzian z chemii, a konkretnie z fascynującego świata węglowodorów. Wiemy, że samo słowo "sprawdzian" może wywoływać lekki dreszcz, ale przygotowaliśmy dla Was obszerny przewodnik, który rozwieje wszelkie wątpliwości i pomoże Wam opanować ten temat od podszewki. Celem tego artykułu jest nie tylko pomoc w nauce do konkretnego sprawdzianu, ale przede wszystkim zbudowanie solidnych fundamentów zrozumienia węglowodorów, które zaprocentują w dalszej edukacji chemicznej. Kierujemy ten tekst do uczniów szkół średnich, którzy stają przed wyzwaniem klasyfikacji, właściwości i reakcji tych podstawowych związków organicznych.
Węglowodory: Podstawa Świata Organicznego
Zacznijmy od początku. Czym właściwie są węglowodory? Jak sama nazwa wskazuje, są to związki chemiczne zbudowane wyłącznie z dwóch pierwiastków: węgla (C) i wodoru (H). To właśnie te proste budulce tworzą niewyobrażalnie złożoną i bogatą różnorodność związków organicznych, które otaczają nas na co dzień. Od paliw napędzających nasze samochody, przez plastikowe opakowania, po złożone cząsteczki w naszych organizmach – wszędzie tam znajdziemy ślady węglowodorów.
Dlaczego Węglowodory Są Tak Ważne?
Warto zdać sobie sprawę z ich kluczowej roli. Węglowodory stanowią:
- Podstawę przemysłu petrochemicznego: ropa naftowa i gaz ziemny to przede wszystkim mieszaniny węglowodorów, które są surowcem do produkcji niezliczonej ilości materiałów.
- Źródło energii: spalanie węglowodorów (np. benzyny, gazu ziemnego) dostarcza energii potrzebnej do ogrzewania, transportu i produkcji prądu.
- Element budulcowy życia: choć nasze organizmy składają się głównie z bardziej złożonych związków, podstawowe szlaki metaboliczne opierają się na przetwarzaniu i modyfikacji prostych węglowodorów.
Klasyfikacja Węglowodorów: Porządek w Chaosie
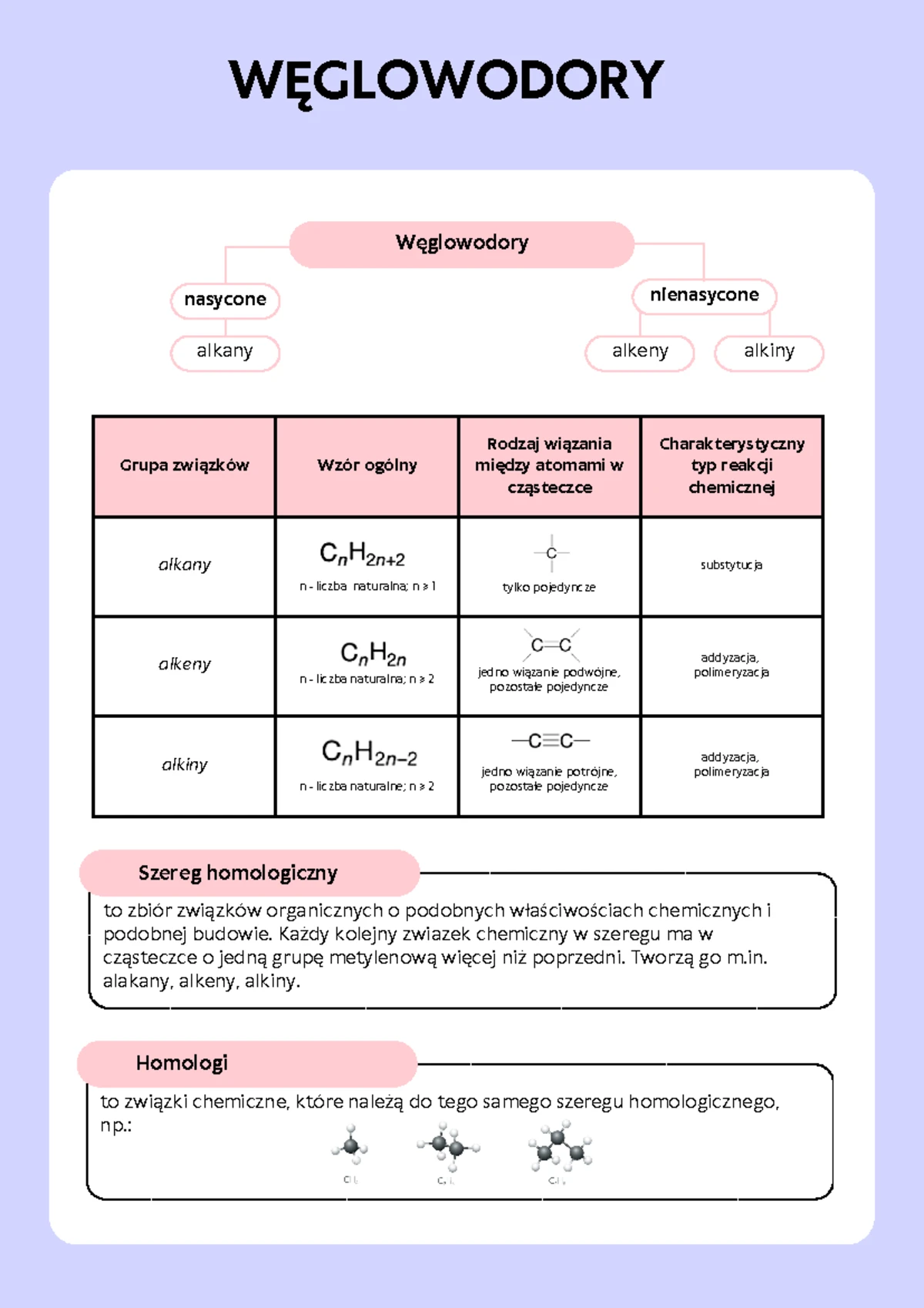
Świat węglowodorów jest ogromny, ale na szczęście możemy go uporządkować, dzieląc je na kilka głównych grup w zależności od typu wiązań między atomami węgla. Zrozumienie tej klasyfikacji to pierwszy krok do sukcesu na sprawdzianie.
1. Alkanes: Nasycone i Stabilne
Alkanes (zwane także parafina) to węglowodory o jednym typie wiązań – pojedynczych, nasyconych wiązaniach węgiel-węgiel i węgiel-wodór. Ich ogólny wzór sumaryczny to CnH2n+2. Oznacza to, że każdy atom węgla jest "nasycony" maksymalną liczbą atomów wodoru. Są one stosunkowo niereaktywne, stąd nazwa "parafina" (od łacińskiego parum affinis – małe powinowactwo).
Przykłady alkanów:
- Metan (CH4): najprostszy alkan, główny składnik gazu ziemnego.
- Etan (C2H6)
- Propan (C3H8): używany jako paliwo w butlach.
- Butan (C4H10): również paliwo w butlach, składnik zapalniczek.
Im dłuższy łańcuch węglowy, tym wyższa temperatura wrzenia i topnienia. Alkanów o krótkich łańcuchach (do C4) są gazami, od C5 do około C17 – cieczami, a dłuższe – ciałami stałymi.
2. Alkeny: Nienasycone i Reaktywne
Alkeny charakteryzują się obecnością przynajmniej jednego podwójnego wiązania węgiel-węgiel. Ogólny wzór sumaryczny dla alkenów posiadających jedno podwójne wiązanie to CnH2n. Obecność wiązania podwójnego sprawia, że alkeny są znacznie bardziej reaktywne niż alkany. Wiązanie podwójne jest zbudowane z jednego wiązania sigma i jednego wiązania pi, które jest słabsze i łatwiejsze do zerwania, co ułatwia reakcje przyłączenia.
Przykłady alkenów:
- Eten (C2H4): znany również jako etylen, jest hormonem roślinnym i kluczowym surowcem do produkcji polietylenu.
- Propen (C3H6): monomer do produkcji polipropylenu.
- Buten (C4H8)
Ważna uwaga: Izomeria geometryczna (cis-trans) jest charakterystyczna dla alkenów, gdzie grupy przyłączone do atomów węgla w wiązaniu podwójnym mogą być po tej samej stronie (cis) lub po przeciwnych stronach (trans) płaszczyzny wiązania.
3. Alkiny: Jeszcze Bardziej Nienasycone
Alkiny to węglowodory zawierające przynajmniej jedno potrójne wiązanie węgiel-węgiel. Ich ogólny wzór sumaryczny dla alkinów z jednym potrójnym wiązaniem to CnH2n-2. Potrójne wiązanie jest jeszcze bardziej reaktywne niż podwójne i składa się z jednego wiązania sigma i dwóch wiązań pi. Alkiny są bardzo reaktywne.
Przykłady alkinów:
- Etyn (C2H2): znany jako acetylen, jest używany w palnikach acetylenowo-tlenowych do spawania i cięcia metali ze względu na bardzo wysoką temperaturę płomienia.
- Propin (C3H4)
- Butyn (C4H6)
4. Węglowodory Aromatyczne: Szczególny Przypadek
Węglowodory aromatyczne to specjalna grupa, której najbardziej znanym przedstawicielem jest benzen (C6H6). Ich budowa opiera się na pierścieniu złożonym z sześciu atomów węgla, gdzie elektrony wiązań są zdelokalizowane, tworząc specyficzny system rezonansowy. Ten system nadaje im wyjątkową stabilność i charakterystyczne właściwości chemiczne, takie jak skłonność do reakcji podstawienia elektrofilowego, a nie przyłączenia.
Cechy węglowodorów aromatycznych:
- Pierścieniowa budowa: zwykle sześcioczłonowy pierścień (jak w benzenie), ale mogą występować też inne wielkości i układy.
- Zdelokalizowane elektrony pi: odpowiedzialne za stabilność i aromatyczność.
- Charakterystyczny zapach: wiele z nich ma intensywne zapachy (stąd nazwa "aromatyczne").
Przykłady: Benzen, toluen (metylbenzen), naftalen.
Reakcje Węglowodorów: Jak Się Zachowują?
Znajomość reakcji to klucz do zrozumienia, jak węglowodory funkcjonują i jak są wykorzystywane. Przyjrzyjmy się najczęściej występującym typom reakcji.
1. Reakcje Alkanów: Spalanie i Podstawienie
Jak już wspomnieliśmy, alkany są mało reaktywne. Ich główne reakcje to:
- Spalanie:
- Całkowite: z nadmiarem tlenu, daje dwutlenek węgla i wodę (np. CH4 + 2O2 → CO2 + 2H2O). To jest reakcja, która dostarcza nam energię.
- Niecałkowite: z ograniczonym dostępem tlenu, może dawać tlenek węgla (czad) i wodę, lub sadzę i wodę (np. 2CH4 + 3O2 → 2CO + 4H2O). Jest to reakcja niebezpieczna!
- Podstawienie wolnorodnikowe: w obecności światła lub pod wpływem wysokiej temperatury, gdzie jeden lub więcej atomów wodoru jest zastępowanych innymi atomami (np. chlorowcami).
2. Reakcje Alkenów i Alkinów: Przyłączenie
Większa reaktywność alkenów i alkinów wynika z obecności wiązań wielokrotnych. Najważniejszą reakcją jest przyłączenie elektrofilowe, gdzie cząsteczki przyłączają się do atomów węgla tworzących wiązanie podwójne lub potrójne, "przesuwając" elektrony z wiązań pi.
Przykłady reakcji przyłączenia:
- Hydrogenacja: przyłączenie wodoru (np. eten + wodór → etan).
- Halogenacja: przyłączenie chloru lub bromu.
- Hydrohalogenacja: przyłączenie chlorowodoru lub bromowodoru (zasada Markownikowa - wodór przyłącza się do tego atomu węgla wiązania podwójnego, który ma więcej atomów wodoru).
- Hydratacja: przyłączenie wody (w obecności kwasów).
Dla alkinów reakcje te zachodzą zazwyczaj dwuetapowo, ponieważ mają dwa wiązania pi do przyłączenia.
3. Reakcje Węglowodorów Aromatycznych: Podstawienie Elektrofilowe
Zaskakująco, mimo obecności elektronów pi, węglowodory aromatyczne wykazują skłonność do podstawienia elektrofilowego, a nie przyłączenia. Jest to spowodowane tym, że reakcja podstawienia zachowuje stabilny system aromatyczny. Elektrofil (cząsteczka lub jon o niedoborze elektronów) atakuje pierścień, zastępując jeden z atomów wodoru.
Przykłady: Halogenowanie, nitrowanie, alkilowanie, acylowanie benzenu.
Węglowodory Cykliczne: Zamknięte Kręgi
Oprócz łańcuchów, atomy węgla mogą tworzyć pierścienie. Wyróżniamy:
- Cyklalkany: są to alkanów, w których łańcuchy tworzą pierścień. Najprostszym przykładem jest cykloheksan (C6H12). Mają wzór sumaryczny CnH2n.
- Cyklalkeny: cykliczne węglowodory z jednym wiązaniem podwójnym w pierścieniu.
- Węglowodory aromatyczne: jak wspomniano wcześniej, są to również węglowodory cykliczne.
Struktura pierścieniowa wpływa na właściwości fizyczne, takie jak temperatura wrzenia i topnienia, a także na reaktywność.
Jak Skutecznie Przygotować Się do Sprawdzianu?
Teraz, gdy mamy już zarys teorii, przejdźmy do praktycznych wskazówek, jak opanować materiał i pewnie stawić czoła sprawdzianowi.
- Ucz się definicji i wzorów sumarycznych: Wiedza o tym, co jest alkanem, alkenem czy alkinem, wraz z ich ogólnymi wzorami, jest absolutnie kluczowa. Zapisz je i powtarzaj regularnie.
- Rysuj struktury: Wizualizacja cząsteczek, ich wiązań i geometrii jest niezwykle pomocna. Ćwicz rysowanie wzorów półstrukturalnych i szkieletowych. Pamiętaj o uwzględnieniu izomerów, gdy jest to możliwe.
- Analizuj reakcje: Zrozum mechanizm reakcji, a nie tylko zapamiętuj równania. Dlaczego alkeny reagują przez przyłączenie? Dlaczego benzen przez podstawienie? Poznanie przyczyn ułatwia zapamiętywanie.
- Rozwiązuj zadania praktyczne: To najlepszy sposób na sprawdzenie swojej wiedzy. Zaczynaj od prostych zadań (np. nazwanie węglowodoru na podstawie wzoru, napisanie równania spalania), a następnie przechodź do trudniejszych (np. określenie produktu reakcji przyłączenia zgodnie z zasadą Markownikowa, napisanie równania reakcji z wykorzystaniem wiedzy o mechanizmie).
- Twórz mapy myśli: Połącz ze sobą kluczowe pojęcia: typy węglowodorów, ich wzory, charakterystyczne wiązania, główne reakcje i przykłady zastosowań. Wizualne przedstawienie zależności pomaga utrwalić wiedzę.
- Ucz się z kolegami: Tłumaczenie materiału innym to świetny sposób na własne utrwalenie. Możecie wspólnie rozwiązywać zadania i dyskutować nad trudniejszymi zagadnieniami.
- Nie bój się pytać: Jeśli czegoś nie rozumiesz, zapytaj nauczyciela, kolegę, poszukaj dodatkowych wyjaśnień w podręczniku lub internecie. Każde pytanie jest ważne!
Podsumowanie: Węglowodory w Naszym Życiu
Węglowodory to nie tylko abstrakcyjne wzory chemiczne. To fundament współczesnej cywilizacji. Od paliw, które pozwalają nam podróżować, przez tworzywa sztuczne, które kształtują nasz świat, aż po molekularne budulce życia – ich wszechobecność jest zdumiewająca. Zrozumienie ich budowy, właściwości i reakcji otwiera drzwi do fascynującego świata chemii organicznej i pozwala lepiej pojmować otaczającą nas rzeczywistość.
Mamy nadzieję, że ten przewodnik dostarczył Wam niezbędnej wiedzy i narzędzi do skutecznego przygotowania się do sprawdzianu. Pamiętajcie o regularnej nauce, praktyce i pozytywnym nastawieniu. Wierzymy, że poradzicie sobie znakomicie! Powodzenia!