Sprawdzian Z Chemii Węgiel I Węglowodory

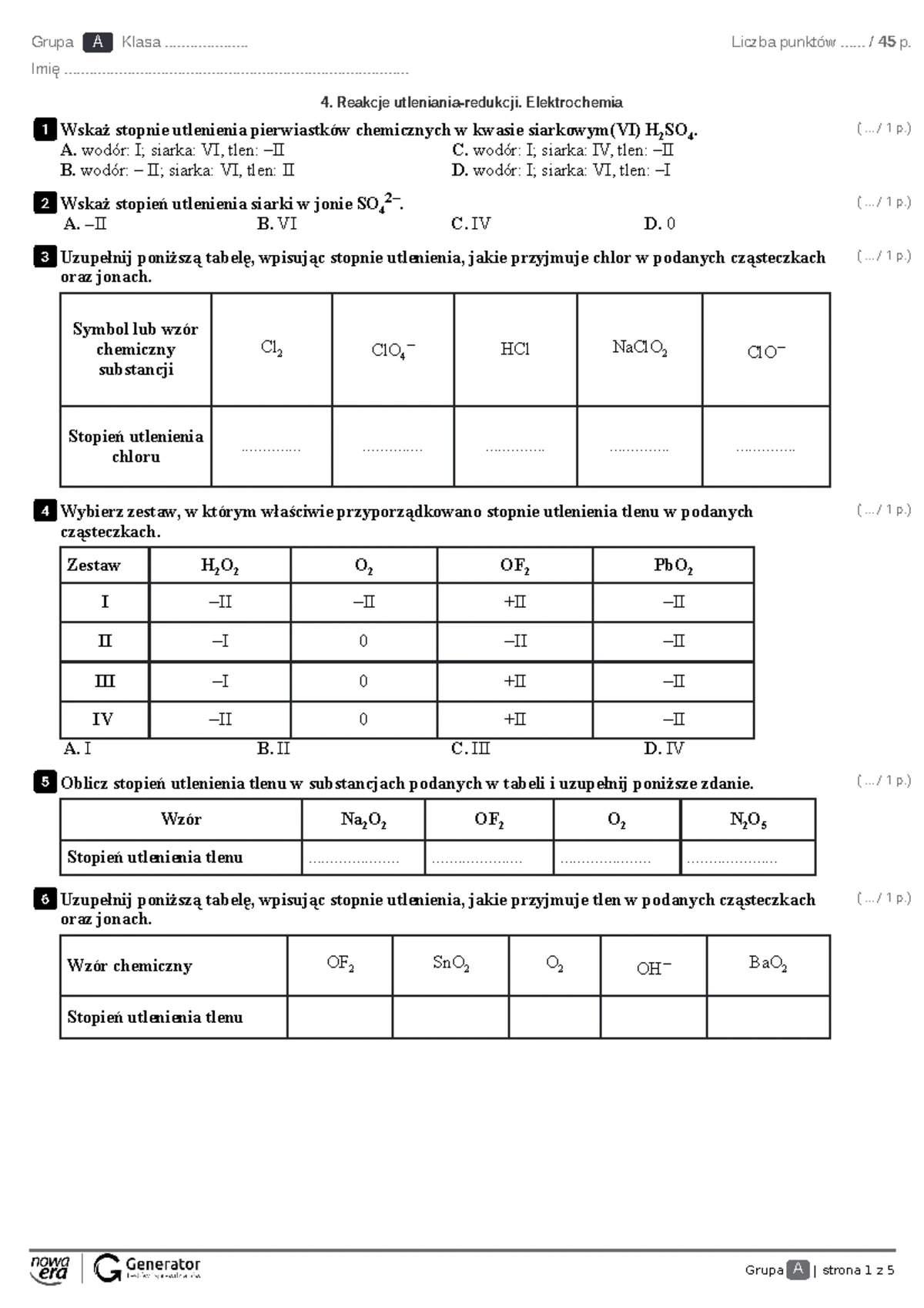
Zbliża się sprawdzian z chemii, a temat węgla i węglowodorów spędza Ci sen z powiek? Doskonale rozumiemy to uczucie. To obszerny dział, pełen wzorów, reakcji i specyficznej nomenklatury. Wielu uczniów czuje się przytłoczonych ilością materiału i obawia się trudności z zapamiętaniem wszystkiego. Nie martw się – nie jesteś sam/a. Ten artykuł ma na celu rozwiać Twoje wątpliwości, uporządkować wiedzę i pokazać, że chemia węgla może być fascynująca i całkiem przystępna.
Pomyśl tylko, węgiel jest przecież podstawą życia na Ziemi. Znajduje się w każdym organizmie żywym, jest paliwem dla naszych samochodów, budulcem plastików i stanowi kluczowy element wielu materiałów, z których korzystamy na co dzień. Zrozumienie jego właściwości i budowy węglowodorów to klucz do zrozumienia świata wokół nas. Skupmy się na tym, by sprawdzian stał się nie tyle wyzwaniem, co okazją do udowodnienia sobie, że potrafisz przyswoić ten ważny dział chemii.
Węgiel – Atom o Niezwykłych Możliwościach
Zacznijmy od samego serca tematu – pierwiastka węgla. Jego unikalne właściwości wynikają przede wszystkim z jego budowy atomowej. Węgiel znajduje się w drugim okresie i grupie 14. układu okresowego pierwiastków. Oznacza to, że jego atom posiada cztery elektrony walencyjne. To właśnie ta cecha sprawia, że węgiel jest tak wszechstronny.
Te cztery elektrony walencyjne mogą tworzyć silne wiązania kowalencyjne z innymi atomami. Ale co najważniejsze, węgiel potrafi tworzyć wiązania nie tylko z innymi pierwiastkami, ale również z samym sobą. Ta zdolność do tworzenia długich, rozgałęzionych, a nawet zamkniętych łańcuchów węglowych jest podstawą ogromnej różnorodności związków organicznych.
Współczesna chemia organiczna liczy miliony związków i wciąż odkrywane są nowe. Ta eksplozja możliwości wynika bezpośrednio z tej prostej zasady: jeden atom węgla może połączyć się z dwoma, trzema, a nawet czterema innymi atomami, tworząc szkielety o zróżnicowanej budowie.
Alotropia Węgla – Różne Twarze Jednego Pierwiastka
Zanim przejdziemy do węglowodorów, warto wspomnieć o odmianach alotropowych węgla. To przykłady tego, jak inaczej ten sam pierwiastek może się prezentować w zależności od sposobu ułożenia atomów w sieci krystalicznej. Najbardziej znane odmiany to:
- Diament: Najtwardsza znana substancja naturalna. Jego atomy węgla są połączone tetraedrycznie, tworząc niezwykle trwałą, trójwymiarową sieć. To sprawia, że jest doskonałym materiałem do narzędzi tnących i polerujących. Jego wysoka twardość i połysk to efekt właśnie tej uporządkowanej struktury.
- Grafit: Miękki, ciemnoszary minerał, doskonale znany jako "pisak" w ołówkach. W grafitie atomy węgla tworzą płaskie warstwy, które są połączone ze sobą słabszymi siłami van der Waalsa. To pozwala warstwom na łatwe ślizganie się po sobie, co nadaje grafitowi jego charakterystyczną ślizgawą konsystencję. Grafit jest również dobrym przewodnikiem prądu elektrycznego, co odróżnia go od diamentu.
- Fullereny: To nowsze odkrycia, struktury kuliste lub eliptyczne, których nazwy często nawiązują do architektury Buckminstera Fullera (np. buckyball C60). Charakteryzują się ciekawymi właściwościami elektronicznymi i optycznymi.
- Grafen: Jednowarstwowa forma grafitu. Jest to niezwykle mocny i lekki materiał, który budzi ogromne nadzieje w dziedzinie elektroniki i inżynierii materiałowej. Jego dwuwymiarowa struktura sprawia, że jest niesamowicie elastyczny i przewodzi prąd lepiej niż miedź.
Zrozumienie tych odmian pokazuje, jak położenie atomów wpływa na makroskopowe właściwości substancji. To fundamentalna lekcja w chemii.
Węglowodory – Podstawa Chemii Organicznej
Teraz przenieśmy naszą uwagę na węglowodory. Jak sama nazwa wskazuje, są to związki chemiczne zbudowane wyłącznie z atomów węgla i wodoru. Stanowią one najprostszą klasę związków organicznych i są niezwykle ważne w kontekście energetycznym i jako surowce do produkcji wielu innych substancji.
Klucz do zrozumienia węglowodorów leży w typach wiązań, jakie atomy węgla mogą tworzyć między sobą:
1. Alkanów: Nasycone, Proste i Stabilne
Alkanów to węglowodory, w których wszystkie wiązania między atomami węgla są wiązaniami pojedynczymi. Nazywamy je węglowodorami nasyconymi, ponieważ atomy węgla są "wysycone" atomami wodoru – nie mogą przyłączyć więcej atomów wodoru bez zerwania istniejących wiązań.
Ogólny wzór alkanów to CnH2n+2, gdzie 'n' to liczba atomów węgla w cząsteczce.
- Metan (CH4): Najprostszy alkan, pierwszy z szeregu. Jest głównym składnikiem gazu ziemnego i powstaje w procesach beztlenowego rozkładu materii organicznej.
- Etan (C2H6): Kolejny alkan, z dwoma atomami węgla.
- Propan (C3H8): Używany jako paliwo w kuchenkach turystycznych i samochodach.
- Butan (C4H10): Składnik paliwa do zapalniczek i aerozoli.
Wraz ze wzrostem liczby atomów węgla, alkanów mogą występować w różnych izomerach – związkach o tym samym wzorze sumarycznym, ale różnej budowie przestrzennej. Na przykład, butan ma dwa izomery: n-butan (łańcuch prosty) i izobutan (łańcuch rozgałęziony). To pokazuje, jak już na tym etapie pojawia się złożoność.
Reakcje alkanów są zazwyczaj mało reaktywne. Najważniejsze to spalanie (np. w silnikach samochodowych) oraz reakcje rozkładu termicznego i halogenowania (pod wpływem światła).
2. Alkenów: Nienasycone i Reaktywne
Alkenów to węglowodory, które posiadają co najmniej jedno wiązanie podwójne między atomami węgla. W obecności wiązania podwójnego, atomy węgla nie są już "wysycone" wodorem, stąd nazwa węglowodory nienasycone. Wiązanie podwójne składa się z jednego wiązania sigma i jednego wiązania pi, które jest słabsze i bardziej dostępne dla reakcji.
Ogólny wzór alkenów posiadających jedno wiązanie podwójne to CnH2n.
- Eten (C2H4): Najprostszy alken, wcześniej znany jako etylen. Jest to hormon roślinny odpowiedzialny za dojrzewanie owoców. W przemyśle jest kluczowy do produkcji polietylenu – jednego z najpowszechniej używanych plastików.
- Propen (C3H6): Stosowany do produkcji polipropylenu, kolejnego ważnego plastiku.
Charakterystyczną cechą alkenów są reakcje przyłączania, gdzie w wyniku zerwania słabszego wiązania pi, do cząsteczki przyłączają się inne atomy lub grupy atomów (np. bromu, chloru, cząsteczki wody). To znacznie zwiększa ich reaktywność w porównaniu do alkanów.
3. Alkinów: Trojaczki i Wyjątkowo Reaktywne
Alkinów to węglowodory zawierające co najmniej jedno wiązanie potrójne między atomami węgla. Wiązanie potrójne jest jeszcze bardziej reaktywne niż podwójne. Powstaje z jednego wiązania sigma i dwóch wiązań pi.
Ogólny wzór alkinów posiadających jedno wiązanie potrójne to CnH2n-2.
- Etyn (C2H2): Wcześniej znany jako acetylen. Jest to bardzo reaktywny gaz, używany do spawania i cięcia metali dzięki bardzo wysokiej temperaturze płomienia. Jest również ważnym prekursorem w syntezie organicznej.
Podobnie jak alkenów, alkinów ulegają reakcjom przyłączania, ale mogą przyłączać jeszcze więcej atomów niż alkenów. Są również podatne na polimeryzację, tworząc długie łańcuchy.
4. Węglowodory Aromatyczne: Szczególna Stabilność i Zapach
Kiedy mówimy o "węglowodorach", często myślimy również o tych o specyficznej, pierścieniowej budowie. Do tej grupy należą węglowodory aromatyczne, na czele z benzenem (C6H6). Benzen ma sześcioczłonowy pierścień, w którym wiązania między atomami węgla mają charakter pośredni między pojedynczym a podwójnym (tzw. wiązanie zdelokalizowane). Ta zdelokalizowana chmura elektronów nadaje cząsteczce szczególną stabilność.
Węglowodory aromatyczne często posiadają charakterystyczny zapach (stąd nazwa "aromatyczne", choć nie wszystkie o przyjemnym zapachu są aromatyczne chemicznie, i nie wszystkie aromatyczne chemicznie przyjemnie pachną).
Przykładami są: toluen i naftalen. Benzen jest ważnym surowcem w przemyśle chemicznym, choć jego toksyczność sprawia, że jego użycie jest ściśle regulowane.
Ważne Reakcje i Zastosowania w Praktyce
Podczas przygotowań do sprawdzianu, zwróć szczególną uwagę na kluczowe reakcje:
- Spalanie: Zarówno całkowite (do CO2 i H2O) jak i niecałkowite (do CO, C, H2O). Jest to reakcja, która napędza nasze społeczeństwo.
- Reakcje przyłączania (do alkenów i alkinów): Z wodorem (uwodornienie), z halogenami (halogenowanie), z wodą (uwodnienie). Pozwalają na przekształcanie węglowodorów nienasyconych w nasycone lub wprowadzanie grup funkcyjnych.
- Reakcje podstawienia (głównie w alkanach i związkach aromatycznych): Wymiana jednego atomu na inny. Przykładem jest chlorowanie alkanów w obecności światła UV.
- Polimeryzacja: Proces, w którym małe cząsteczki (monomery) łączą się w bardzo długie łańcuchy (polimery). To klucz do produkcji plastików, od polietylenu, przez polipropylen, po PVC.
Praktyczne zastosowania węglowodorów są wszechobecne:
- Paliwa: Benzyna, olej napędowy, gaz ziemny, propan-butan – to wszystko są mieszaniny węglowodorów, które dostarczają nam energii. Przykładowo, ropa naftowa jest złożoną mieszaniną różnych węglowodorów, która po destylacji frakcyjnej daje nam szereg cennych produktów.
- Tworzywa sztuczne: Polimery oparte na etenie, propenie i innych monomerach węglowodorowych są fundamentem nowoczesnego przemysłu.
- Rozpuszczalniki: Wiele węglowodorów, takich jak toluen czy ksylen, jest używanych jako rozpuszczalniki w farbach, lakierach i klejach.
- Materiały budowlane i izolacyjne: Pochodne węglowodorów znajdują zastosowanie w produkcji styropianu i innych materiałów.
Jak Skutecznie Przygotować Się do Sprawdzianu?
Przygotowanie do sprawdzianu wymaga systematyczności. Oto kilka praktycznych wskazówek:
- Zacznij od podstaw: Upewnij się, że rozumiesz budowę atomu węgla, jego czteroelektronową konfigurację walencyjną i zdolność do tworzenia wiązań.
- Poznaj nazewnictwo: Systematyczne nazewnictwo związków organicznych (system IUPAC) jest kluczowe. Naucz się przedrostków (met-, et-, prop-, but-) i przyrostków (-an, -en, -yn).
- Rysuj wzory: Wizualizacja cząsteczek jest niezwykle pomocna. Rysuj wzory półstrukturalne i strukturalne. Zwracaj uwagę na geometryczne ułożenie atomów.
- Ucz się reakcji parami: Porównuj reaktywność alkanów, alkenów i alkinów. Zrozum, dlaczego alkenów i alkinów są bardziej reaktywne (obecność wiązań pi).
- Twórz mapy myśli: Połącz różne klasy węglowodorów i ich kluczowe cechy. Pomaga to zobaczyć całościowy obraz.
- Rozwiązuj zadania praktyczne: Ćwiczenia z książki, zadania z poprzednich sprawdzianów – to najlepszy sposób na utrwalenie wiedzy i sprawdzenie, co sprawia Ci trudność.
- Wykorzystaj zasoby online: Istnieje wiele świetnych filmów edukacyjnych, interaktywnych ćwiczeń i symulacji, które mogą pomóc w zrozumieniu trudnych zagadnień.
Pamiętaj, że zrozumienie węglowodorów to dopiero początek fascynującej podróży po świecie chemii organicznej. To dział, który ma ogromne znaczenie praktyczne. Im lepiej go opanujesz, tym łatwiej będzie Ci zrozumieć bardziej złożone związki, takie jak alkohole, kwasy karboksylowe czy węglowodany.
Nie pozwól, aby strach przed sprawdzianem Cię sparaliżował. Podejdź do niego z pozytywnym nastawieniem, systematycznie pracuj i pamiętaj, że chemia jest logiczna – jeśli zrozumiesz podstawy, wszystko inne zacznie układać się w spójną całość. Powodzenia!