Sprawdzian Z Chemi Wodorotlenki I Tlenki

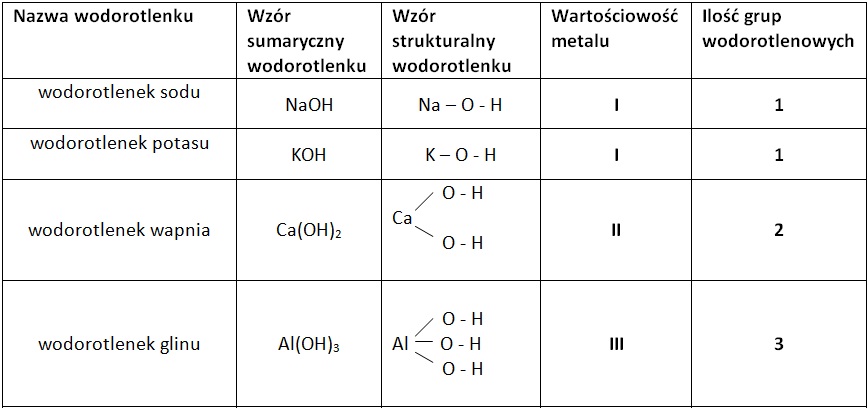
Wodorotlenki to związki chemiczne zbudowane z atomów metalu (lub jonu amonowego NH4+) oraz grupy hydroksylowej (-OH). Wodorotlenki reagują z kwasami, tworząc sole i wodę w reakcji neutralizacji. Mogą mieć charakter zasadowy (rozpuszczalne w wodzie, np. NaOH, KOH) lub amfoteryczny (reagują zarówno z kwasami, jak i zasadami, np. Al(OH)3, Zn(OH)2). Nierozpuszczalne wodorotlenki reagują tylko z kwasami.
Key aspects of hydroxides include:
- Budowa: Składają się z kationu metalu i anionu hydroksylowego.
- Wiązanie: Zazwyczaj jest to wiązanie jonowe między kationem metalu a grupą hydroksylową.
- Nazewnictwo: Nazwy tworzy się od nazwy metalu z dodaniem słowa "wodorotlenek". Dla metali o zmiennej wartościowości podaje się ją w nawiasie, np. wodorotlenek żelaza(III).
- Właściwości fizyczne: Wodorotlenki zasadowe często są ciałami stałymi, rozpuszczalnymi w wodzie, tworząc roztwory o odczynie zasadowym.
- Właściwości chemiczne:
- Reakcja z kwasami (neutralizacja): Metal(OH)n + nHX → MetalXn + nH2O
- Reakcja z tlenkami kwasowymi (wodorotlenki zasadowe): 2NaOH + SO2 → Na2SO3 + H2O
- Rozkład termiczny (niektóre): 2Al(OH)3 podgrzanie→ Al2O3 + 3H2O
Tlenki to związki chemiczne, w których jeden z pierwiastków jest tlenem o stopniu utlenienia -II, a drugim pierwiastkiem jest inny pierwiastek. Tlenki dzielimy na tlenki metali (zasadowe lub amfoteryczne) i tlenki niemetali (kwasowe lub obojętne). Tlenki metali zasadowych reagują z wodą, tworząc wodorotlenki zasadowe.
Key aspects of oxides include:
- Budowa: Złożone z tlenu i innego pierwiastka.
- Nazewnictwo: Nazywa się je zazwyczaj dodając przedrostki określające liczbę atomów tlenu i pierwiastka, np. tlenek siarki(IV) (SO2), tlenek węgla(IV) (CO2). Dla prostszych tlenków stosuje się też nazwy zwyczajowe, np. woda (H2O), dwutlenek węgla (CO2).
- Podział:
- Tlenki metali:
- Zasadowe: Reagują z wodą, tworząc wodorotlenki zasadowe (np. Na2O, CaO).
- Amfoteryczne: Reagują zarówno z kwasami, jak i zasadami (np. Al2O3, ZnO).
- Tlenki niemetali:
- Kwasowe: Reagują z wodą, tworząc kwasy beztlenowe lub tlenowe (np. SO3, P4O10).
- Obojętne: Nie reagują z kwasami, zasadami ani wodą (np. CO, NO).
- Tlenki metali:
- Właściwości chemiczne:
- Reakcja z wodą (tlenki zasadowe i kwasowe).
- Reakcja z kwasami (tlenki zasadowe i amfoteryczne).
- Reakcja z zasadami (tlenki kwasowe i amfoteryczne).
- Reakcja z innymi tlenkami (np. SO2 + CaO → CaSO3).
Przykład wodorotlenku: Wodorotlenek sodu (NaOH) – silna zasada, żrąca substancja stała, dobrze rozpuszczalna w wodzie. Reaguje z kwasem solnym: NaOH + HCl → NaCl + H2O.
Przykład tlenku: Tlenek magnezu (MgO) – tlenek metalu zasadowego. Reaguje z wodą, tworząc wodorotlenek magnezu: MgO + H2O → Mg(OH)2. MgO jest białą, stałą substancją, stosowaną np. jako środek zobojętniający nadkwasotę żołądkową.
Zastosowanie w praktyce: Wodorotlenki, takie jak wodorotlenek sodu, są szeroko stosowane w produkcji mydła, papieru i detergentów. Tlenki, na przykład tlenek żelaza, są kluczowymi składnikami pigmentów i materiałów budowlanych. Wodorotlenki i tlenki odgrywają fundamentalne role w procesach przemysłowych i codziennym życiu.