Sprawdzian Z Budowy Atomu Kl 1 Gimnazjum

Pierwsza klasa gimnazjum to czas odkryć i nowych wyzwań edukacyjnych. Jednym z fundamentalnych zagadnień, które pojawiają się na lekcjach przyrody i chemii, jest budowa atomu. Choć koncepcja ta może wydawać się abstrakcyjna, zrozumienie jej podstaw jest kluczowe dla dalszego zgłębiania nauk ścisłych.
Sprawdzian z budowy atomu dla pierwszej klasy gimnazjum ma na celu weryfikację wiedzy uczniów na temat podstawowych elementów składowych materii. To nie tylko test umiejętności zapamiętywania, ale przede wszystkim sprawdzian zrozumienia podstawowych zasad rządzących światem mikroskopijnym.
W niniejszym artykule przyjrzymy się kluczowym zagadnieniom, które zazwyczaj pojawiają się na takich sprawdzianach, podpowiemy, na co zwrócić szczególną uwagę podczas nauki i przedstawimy przykłady, które pomogą w lepszym zrozumieniu omawianych tematów.
Kluczowe Zagadnienia Sprawdzianu z Budowy Atomu
Sprawdziany z budowy atomu w pierwszej klasie gimnazjum koncentrują się zazwyczaj na kilku fundamentalnych obszarach:
1. Podstawowe Cząstki Atomu
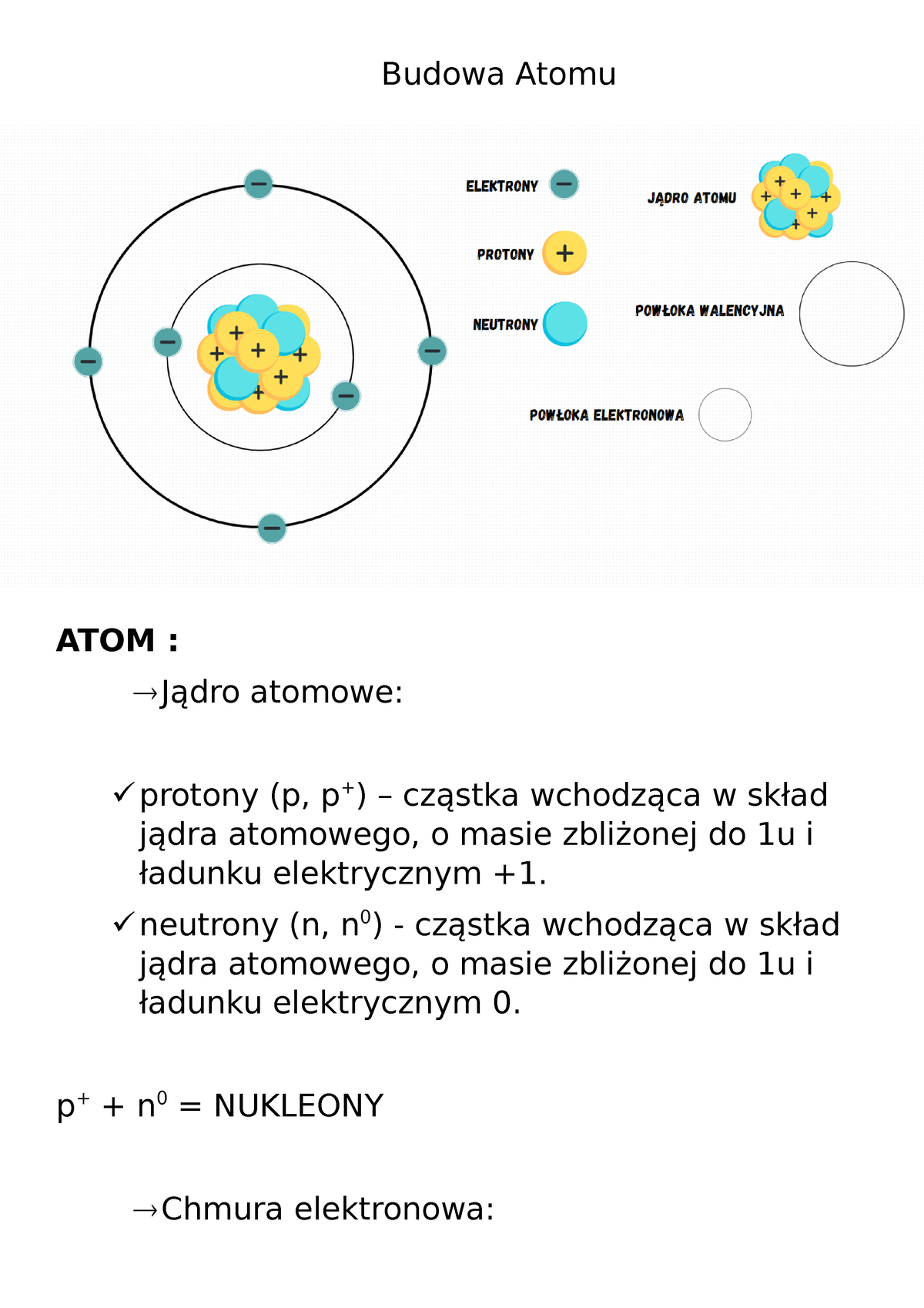
Centralnym punktem zrozumienia budowy atomu jest znajomość jego podstawowych składników. Uczniowie powinni wiedzieć, że atom składa się z:
- Jądra atomowego: Stanowiącego centrum atomu, niezwykle gęstego i naładowanego dodatnio. W skład jądra wchodzą dwa rodzaje cząstek:
- Protony: Cząstki o ładunku dodatnim (+1), które decydują o tożsamości pierwiastka.
- Neutrony: Cząstki obojętne elektrycznie (ładunek 0), które wpływają na masę atomu.
- Elektronów: Cząstki o ładunku ujemnym (-1), krążące wokół jądra po określonych orbitach lub w powłokach elektronowych. Liczba elektronów w atomie obojętnym elektrycznie jest równa liczbie protonów.
Zrozumienie tych trzech podstawowych cząstek (protony, neutrony, elektrony) i ich właściwości (ładunek, położenie w atomie) jest absolutnym fundamentem.
2. Liczba Atomowa i Masowa
Kolejnym istotnym elementem jest zrozumienie, jak opisujemy poszczególne atomy. Dwa kluczowe pojęcia to:
- Liczba atomowa (Z): Jest to liczba protonów w jądrze atomu. Każdy pierwiastek chemiczny charakteryzuje się unikalną liczbą atomową. Jest to niejako "dowód tożsamości" pierwiastka. Na przykład, atom wodoru ma zawsze 1 proton (Z=1), a atom helu ma 2 protony (Z=2).
- Liczba masowa (A): Jest to suma liczby protonów i neutronów w jądrze atomu. Określa ona w przybliżeniu masę atomu, ponieważ protony i neutrony są znacznie cięższe od elektronów. Liczba masowa jest oznaczana jako A = Z + N, gdzie N to liczba neutronów.
Pamiętajmy, że to liczba protonów definiuje pierwiastek, a liczba neutronów może się zmieniać, prowadząc do powstania tzw. izotopów.
3. Izotopy
Izotopy to atomy tego samego pierwiastka, które mają tę samą liczbę protonów (czyli tę samą liczbę atomową Z), ale różnią się liczbą neutronów w jądrze. Różnica w liczbie neutronów oznacza, że izotopy tego samego pierwiastka mają różne liczby masowe.
Przykład: Wodór
- Prot (1H): 1 proton, 0 neutronów. Liczba atomowa Z=1, liczba masowa A=1.
- Deuter (2H): 1 proton, 1 neutron. Liczba atomowa Z=1, liczba masowa A=2.
- Tryt (3H): 1 proton, 2 neutrony. Liczba atomowa Z=1, liczba masowa A=3.
Wszystkie trzy są formami wodoru, ponieważ mają po jednym protonie, ale różnią się masą. Izotopy mają podobne właściwości chemiczne, ponieważ liczba elektronów jest taka sama, ale mogą różnić się właściwościami fizycznymi.
4. Układ Okresowy Pierwiastków
Układ okresowy pierwiastków jest nieodłącznym narzędziem w nauce o budowie atomu. Uczniowie powinni umieć odczytywać podstawowe informacje z układu, takie jak:
- Symbol pierwiastka (np. H dla wodoru, O dla tlenu).
- Nazwa pierwiastka.
- Liczba atomowa (Z), zazwyczaj umieszczona nad symbolem.
- Masa atomowa (zwykle średnia masa atomowa dla występujących izotopów, zazwyczaj pod symbolem).
Układ okresowy jest logicznie uporządkowany, co pomaga w zrozumieniu zależności między pierwiastkami. Grupowanie pierwiastków w okresach i grupach odzwierciedla powtarzalność ich właściwości chemicznych, która wynika z budowy ich powłok elektronowych.
5. Modele Atomu (Uproszczone)
W pierwszej klasie gimnazjum zazwyczaj przedstawiane są uproszczone modele atomu. Najczęściej pojawiają się:
- Model atomu Bohra: W tym modelu elektrony krążą wokół jądra po ustalonych orbitach, podobnie jak planety wokół Słońca. Każda orbita odpowiada określonemu poziomowi energetycznemu.
- Model atomu Rutherforda: Wcześniejszy model, w którym jądro jest otoczone przez elektrony krążące swobodnie.
Ważne jest, aby zrozumieć ideę, że atom nie jest jednolitą, niepodzielną kulką, ale ma pewną strukturę wewnętrzną.
6. Ładunek Elektryczny Atomu
W stanie podstawowym, czyli gdy atom jest obojętny elektrycznie, liczba protonów (ładunek dodatni) jest równa liczbie elektronów (ładunek ujemny). Suma ładunków dodatnich i ujemnych wynosi zero.
Jeśli atom zyska lub straci elektrony, staje się jonem.
- Jon dodatni (kation): Powstaje, gdy atom straci elektrony. Ma więcej protonów niż elektronów, więc jego ładunek jest dodatni.
- Jon ujemny (anion): Powstaje, gdy atom zyska elektrony. Ma więcej elektronów niż protonów, więc jego ładunek jest ujemny.
Rozumienie procesu jonizacji jest kluczowe dla dalszej nauki chemii, zwłaszcza podczas omawiania wiązań chemicznych.
Jak Się Przygotować do Sprawdzianu?
Efektywne przygotowanie do sprawdzianu z budowy atomu wymaga systematyczności i zrozumienia materiału:
1. Regularna Nauka i Powtórki
Nie zostawiaj nauki na ostatnią chwilę. Regularne powtarzanie materiału, analizowanie notatek z lekcji i rozwiązywanie ćwiczeń pozwoli utrwalić wiedzę.
2. Zrozumienie Zamiast Zapamiętywania
Staraj się zrozumieć, dlaczego tak jest, a nie tylko zapamiętywać fakty. Pytaj "dlaczego?", gdy czegoś nie rozumiesz. Nauczyciel lub koledzy mogą pomóc rozwiać wątpliwości.
3. Wizualizacje i Schematy
Budowa atomu jest tematem wymagającym wizualizacji. Rysuj schematy atomów, jądra, orbit elektronowych. Korzystaj z animacji i filmów edukacyjnych dostępnych online.
Przykład: Narysuj schemat atomu tlenu. Wiesz, że liczba atomowa tlenu (O) to 8. Oznacza to, że ma 8 protonów w jądrze. Jeśli atom jest obojętny, ma również 8 elektronów. Możesz zaznaczyć 8 protonów i, na przykład, 8 neutronów w jądrze, a następnie narysować 2 elektrony na pierwszej powłoce i 6 na drugiej.
4. Rozwiązywanie Zadań
Praktyka czyni mistrza. Rozwiązuj jak najwięcej zadań dotyczących liczby atomowej, masowej, izotopów i jonów. Zwróć uwagę na zadania, w których trzeba obliczyć liczbę neutronów lub ustalić, jaki to pierwiastek na podstawie podanych danych.
5. Korzystanie z Materiałów Dodatkowych
Nie ograniczaj się tylko do podręcznika. Szukaj dodatkowych informacji w internecie, encyklopediach, książkach popularnonaukowych. Istnieje wiele świetnych zasobów online, które w przystępny sposób wyjaśniają budowę atomu.
Przykłady z Życia Codziennego
Choć atomy są niewidoczne gołym okiem, ich istnienie i właściwości mają ogromny wpływ na nasze życie:
- Woda (H2O): Zbudowana jest z atomów wodoru i tlenu. Różnice w budowie tych atomów (liczba protonów, elektronów) decydują o tym, jak atomy te łączą się ze sobą, tworząc cząsteczkę wody, której właściwości znamy - jest niezbędna do życia.
- Metale: Na przykład, żelazo (Fe) w naszych narzędziach czy stal nierdzewna w naczyniach kuchennych. Charakterystyczne właściwości metali (przewodnictwo elektryczne i cieplne, ciągliwość) wynikają z budowy ich atomów i sposobu, w jaki elektrony są rozmieszczone na zewnętrznych powłokach.
- Gaz Ziemny (głównie metan, CH4): Wykorzystywany do ogrzewania naszych domów. Jest to związek chemiczny powstały z atomów węgla i wodoru, których budowa decyduje o tym, że może być paliwem.
- Sól kuchenna (chlorek sodu, NaCl): Zbudowana z atomów sodu (Na) i chloru (Cl). To, że jeden atom łatwo traci elektron (sód), a drugi łatwo go przyjmuje (chlor), prowadzi do powstania silnego wiązania jonowego, tworząc chlorek sodu.
Zrozumienie budowy atomu pozwala docenić, jak złożony i fascynujący jest świat wokół nas, od najmniejszych cząstek po największe struktury.
Podsumowanie
Sprawdzian z budowy atomu w pierwszej klasie gimnazjum to ważny etap w edukacji młodego człowieka. Jest to test podstawowej wiedzy, która będzie stanowić fundament dla dalszych, bardziej zaawansowanych zagadnień z chemii i fizyki. Kluczowe jest zrozumienie, że atom nie jest monolitem, lecz posiada wewnętrzną strukturę składającą się z protonów, neutronów i elektronów. Znajomość pojęć takich jak liczba atomowa, masowa i izotopy, a także umiejętność odczytywania informacji z układu okresowego, są niezbędne do sukcesu.
Zachęcamy uczniów do aktywnego uczenia się, zadawania pytań i korzystania z różnorodnych materiałów. Pamiętajcie, że nauka o budowie atomu to nie tylko przygotowanie do sprawdzianu, ale przede wszystkim fascynująca podróż do świata fundamentalnych praw natury, które rządzą naszym wszechświatem.
Powodzenia w nauce i na sprawdzianie!