Sprawdzian Z Alkoholi Chemia 3 Gimnazjum

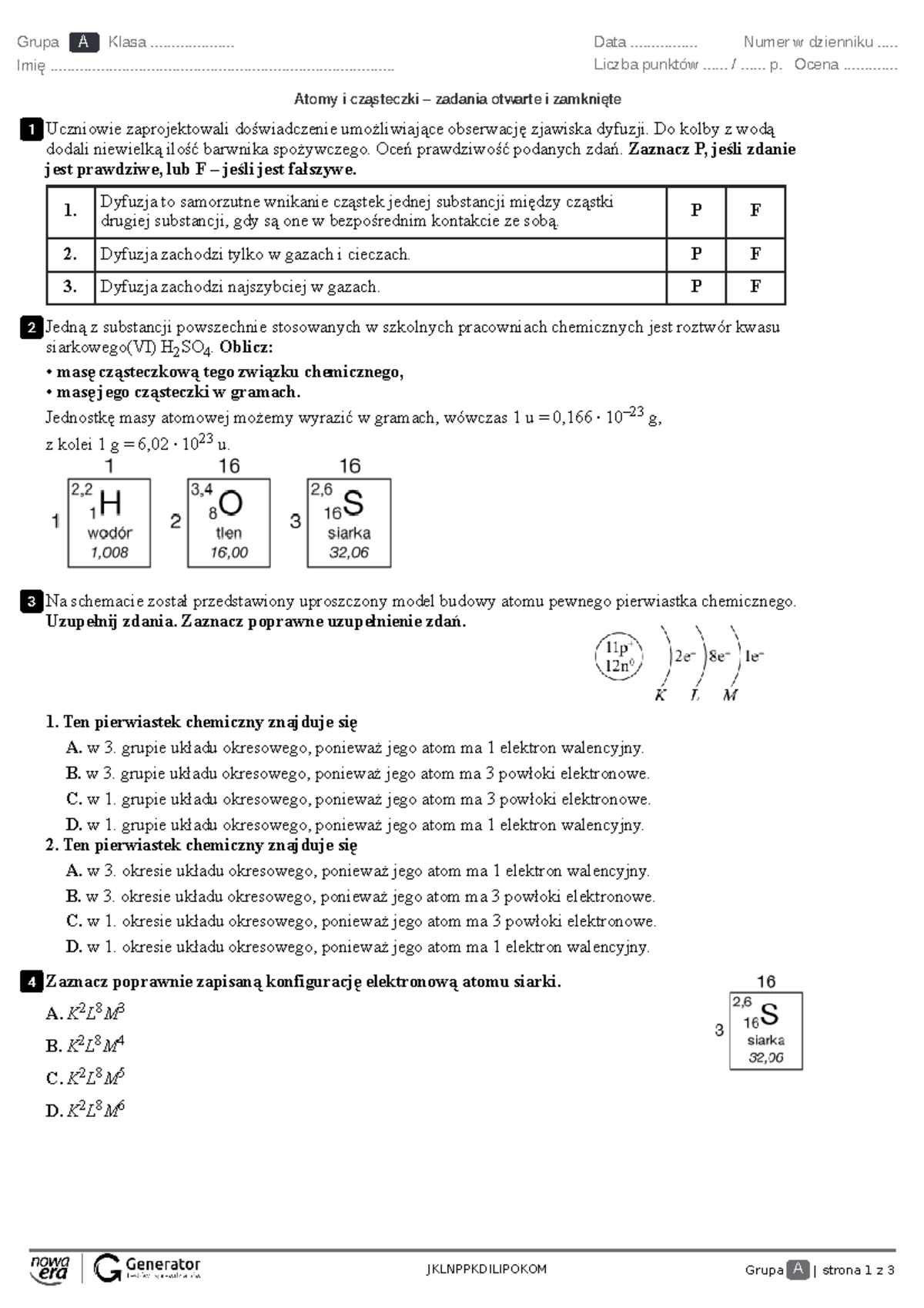
Zbliża się sprawdzian z alkoholi, a Ty czujesz lekkie zdenerwowanie? Nic dziwnego! Temat ten może wydawać się skomplikowany, ale z odpowiednim przygotowaniem stanie się dla Ciebie jasny i zrozumiały. Ten artykuł został stworzony z myślą o Tobie – uczniu trzeciej klasy gimnazjum, który chce opanować materiał i z pewnością podejść do klasówki. Razem odkryjemy tajniki alkoholi, ich budowę, właściwości i zastosowania, tak abyś czuł się kompletnie przygotowany.
Pamiętaj, że chemia to nie tylko suche wzory, ale przede wszystkim fascynujący świat cząsteczek, które otaczają nas wszędzie. Alkohole są tego doskonałym przykładem – od płynów dezynfekujących w apteczce, po składniki wielu produktów spożywczych. Zrozumienie ich budowy i reakcji to klucz do sukcesu na sprawdzianie i otwarcia drzwi do dalszej nauki chemii.
Czym są Alkohole? Podstawy, które musisz znać
Zacznijmy od absolutnych podstaw. Czym właściwie są alkohole w świecie chemii? Najprościej mówiąc, to grupa związków organicznych, które charakteryzują się obecnością grupy hydroksylowej (-OH) przyłączonej do atomu węgla. Ta właśnie grupa nadaje im specyficzne właściwości. To ona jest odpowiedzialna za wiele reakcji, które będziemy omawiać.
Ogólny wzór alkoholi to R-OH, gdzie 'R' symbolizuje grupę alkilową, czyli fragment cząsteczki zbudowany tylko z atomów węgla i wodoru, o budowie nasyconej (zawierającej tylko pojedyncze wiązania między atomami węgla). Możemy je zatem traktować jako pochodne węglowodorów, w których jeden lub więcej atomów wodoru zostało zastąpionych przez grupę -OH.
Nomenklatura i Homologi Alkohole
Aby dobrze zrozumieć alkohole, musimy nauczyć się je nazywać. Podstawą jest nazwa węglowodoru, od którego pochodzi alkohol, zakończona przyrostkiem "-ol". Przykłady:
- Metan (CH4) daje metanol (CH3OH).
- Etan (C2H6) daje etanol (C2H5OH).
- Propan (C3H8) daje propanol (C3H7OH).
Szereg homologiczny alkoholi to seria związków, które mają podobną budowę chemiczną i właściwości, a kolejne związki różnią się od siebie o jedną grupę metylenową (-CH2-). Zaczynając od metanolu, każdy kolejny alkohol z tego szeregu jest o tę grupę bogatszy. To pozwala nam przewidywać właściwości kolejnych alkoholi na podstawie tych, które już znamy. Na przykład, wraz ze wzrostem liczby atomów węgla w cząsteczce, zmienia się ich stan skupienia (od cieczy do ciał stałych) i rozpuszczalność w wodzie (maleje).
Właściwości Alkohole – Co Musisz Zapamiętać?
Alkohole wykazują szereg charakterystycznych właściwości fizycznych i chemicznych, które są kluczowe do zrozumienia ich zachowania. Przygotuj się na zapamiętanie tych najważniejszych!
Właściwości Fizyczne
Najprostsze alkohole, takie jak metanol i etanol, to bezbarwne ciecze o specyficznym zapachu. Są lotne i palne, co warto podkreślić. Ich gęstość jest zazwyczaj mniejsza od gęstości wody.
- Stan skupienia: Metanol i etanol są cieczami w temperaturze pokojowej. Wyższe homologii stają się ciałami stałymi.
- Rozpuszczalność w wodzie: Alkohole o krótkich łańcuchach węglowych (do 4 atomów węgla) są dobrze rozpuszczalne w wodzie dzięki obecności grupy hydroksylowej, która potrafi tworzyć wiązania wodorowe z cząsteczkami wody. W miarę wydłużania się łańcucha węglowego, część hydrofobowa (niepolarne alkilowa) staje się dominująca, co powoduje zmniejszenie rozpuszczalności.
- Temperatura wrzenia: Alkohole mają zazwyczaj wyższe temperatury wrzenia niż węglowodory o podobnej masie cząsteczkowej. Jest to spowodowane możliwością tworzenia wiązań wodorowych między cząsteczkami alkoholu, co wymaga dostarczenia większej energii do ich zerwania.
Właściwości Chemiczne
Grupa hydroksylowa (-OH) jest centrum reaktywności alkoholi. To dzięki niej mogą one ulegać różnorodnym przemianom chemicznym:
- Reakcja spalania: Alkohole są związkami palnymi. Ulegają spalaniu całkowitemu (w nadmiarze tlenu) do dwutlenku węgla i wody, oraz spalaniu niecałkowitemu (przy ograniczonym dostępie tlenu), dając tlenek węgla (czad) i wodę. To ważny aspekt ich bezpiecznego użytkowania.
- Spalanie całkowite: CxHyOH + O2 → CO2 + H2O (należy zbilansować)
- Spalanie niecałkowite: CxHyOH + O2 → CO + H2O (należy zbilansować)
- Reakcja z metalami aktywnymi: Alkohole reagują z metalami aktywnymi, takimi jak sód, wydzielając wodór i tworząc alkoholany. Jest to dowód na kwasowy charakter grupy -OH, choć jest on znacznie słabszy niż kwasów.
- 2 C2H5OH + 2 Na → 2 C2H5ONa (etanolan sodu) + H2↑
- Reakcja utleniania: Alkohole mogą być utleniane do aldehydów (alkohole pierwszorzędowe) lub ketonów (alkohole drugorzędowe). Dalsze utlenianie alkoholi pierwszorzędowych prowadzi do powstania kwasów karboksylowych. Jest to bardzo ważna reakcja, często wykorzystywana w przemyśle.
- Utlenianie alkoholu pierwszorzędowego do aldehydu (np. etanalu z etanolu).
- Utlenianie alkoholu drugorzędowego do ketonu (np. acetonu z propan-2-olu).
- Dalsze utlenianie aldehydu do kwasu karboksylowego (np. kwasu etanowego z etanalu).
- Reakcja estryfikacji: Alkohole reagują z kwasami karboksylowymi w obecności katalizatora (np. stężonego kwasu siarkowego(VI)) tworząc estry i wodę. Estry to związki o przyjemnym zapachu, wykorzystywane jako aromaty w przemyśle spożywczym i kosmetycznym.
- R-OH + R'-COOH ⇌ R'-COOR + H2O
Najważniejsze Alkohole – Kim Są Bohaterowie Sprawdzianu?
Na sprawdzianie z pewnością pojawią się te najbardziej znane i powszechne alkohole. Przyjrzyjmy się im bliżej:
Metanol (Alkohol Metylowny)
- Wzór sumaryczny: CH3OH
- Budowa: Najprostszy alkohol.
- Właściwości: Silnie toksyczny! Powoduje ślepotę, uszkodzenia narządów wewnętrznych, a nawet śmierć. Jest to bardzo ważne do zapamiętania ze względu na zagrożenia związane z jego spożyciem.
- Zastosowania: Rozpuszczalnik, produkcja formaldehydu, paliwo.
Etanol (Alkohol Etylowy, Spirytus)
- Wzór sumaryczny: C2H5OH
- Budowa: Bardzo popularny związek.
- Właściwości: Palny, lotny, bezbarwny, o charakterystycznym zapachu. W małych ilościach może działać dezynfekująco, ale spożywany w nadmiarze jest szkodliwy dla zdrowia. Jest to substancja psychoaktywna.
- Zastosowania: Produkcja napojów alkoholowych (uwaga na regulacje prawne!), rozpuszczalnik, paliwo (bioetanol), składnik leków i kosmetyków, środki dezynfekujące.
Glicerol (Gliceryna)
- Wzór sumaryczny: C3H5(OH)3
- Budowa: Jest to alkohol trójhydroksylowy, co oznacza, że w jego cząsteczce znajdują się trzy grupy hydroksylowe.
- Właściwości: Bezbarwna, gęsta ciecz, higroskopijna (chłonie wodę z otoczenia), ma słodki smak. Jest nietoksyczny.
- Zastosowania: Kosmetyka (nawilżanie skóry), przemysł spożywczy (dodatek do żywności), farmacja, produkcja materiałów wybuchowych (np. nitrogliceryny).
Jak Przygotować Się do Sprawdzianu?
Teraz, gdy poznaliśmy podstawy, czas na praktyczne wskazówki, które pomogą Ci skutecznie przygotować się do sprawdzianu.
Systematyczna Nauka
Kluczem do sukcesu jest systematyczność. Nie zostawiaj wszystkiego na ostatnią chwilę! Przerabiaj materiał etapami, codziennie poświęcając trochę czasu na powtórki.
Zrozumienie Zamiast Wkuwania
Staraj się zrozumieć, dlaczego dany związek ma takie właściwości, a nie inne. Dlaczego grupa -OH jest tak ważna? Jakie reakcje zachodzą i dlaczego? Kiedy rozumiesz mechanizm, łatwiej zapamiętać i zastosować wiedzę.
Rozwiązywanie Zadań
Większość sprawdzianów zawiera zadania praktyczne. Rozwiązuj jak najwięcej zadań z podręcznika, zeszytu ćwiczeń, a także zadań zamieszczonych w internecie. Skup się na:
- Ustalaniu wzorów związków.
- Bilansowaniu reakcji chemicznych.
- Określaniu produktów reakcji.
- Opisywaniu właściwości fizycznych i chemicznych.
- Rozpoznawaniu konkretnych alkoholi.
Tworzenie Map Myśli i Notatek
Dla wielu osób wizualne notatki i mapy myśli są bardzo pomocne. Zapisuj najważniejsze informacje w skondensowanej formie, używając kolorów i rysunków, aby ułatwić sobie zapamiętywanie.
Pytaj o Pomoc
Jeśli czegoś nie rozumiesz, nie bój się pytać nauczyciela, kolegów lub koleżanek. Wyjaśnienie wątpliwości jest kluczowe do pełnego zrozumienia materiału.
Przykładowe Pytania ze Sprawdzianu
Aby dać Ci pewien obraz tego, czego możesz się spodziewać, oto kilka przykładowych pytań:
- Podaj wzór sumaryczny i półstrukturalny etanolu.
- Wymień dwie właściwości fizyczne etanolu.
- Napisz równanie reakcji spalania całkowitego metanolu.
- Opisz, jak rozpoznać, czy dana substancja jest alkoholem.
- Podaj zastosowanie glicerolu w przemyśle kosmetycznym.
- Który alkohol jest silnie toksyczny i może spowodować ślepotę?
- Napisz równanie reakcji estryfikacji kwasu octowego z etanolem.
Pamiętaj, że przygotowanie to najlepsza strategia na sukces. Wiedz, że masz w sobie potencjał do opanowania tego materiału. Wiedz, że każdy krok w nauce przybliża Cię do celu. Zamiast myśleć o stresie, skup się na zdobywaniu wiedzy. Chemia może być naprawdę fascynująca, a alkohole to tylko jeden z wielu jej ciekawych obszarów!
Życzymy Ci powodzenia na sprawdzianie! Jesteśmy pewni, że z odpowiednim przygotowaniem poradzisz sobie doskonale!