Sprawdzian Z 2semestru Z Chemi Gimnazjum
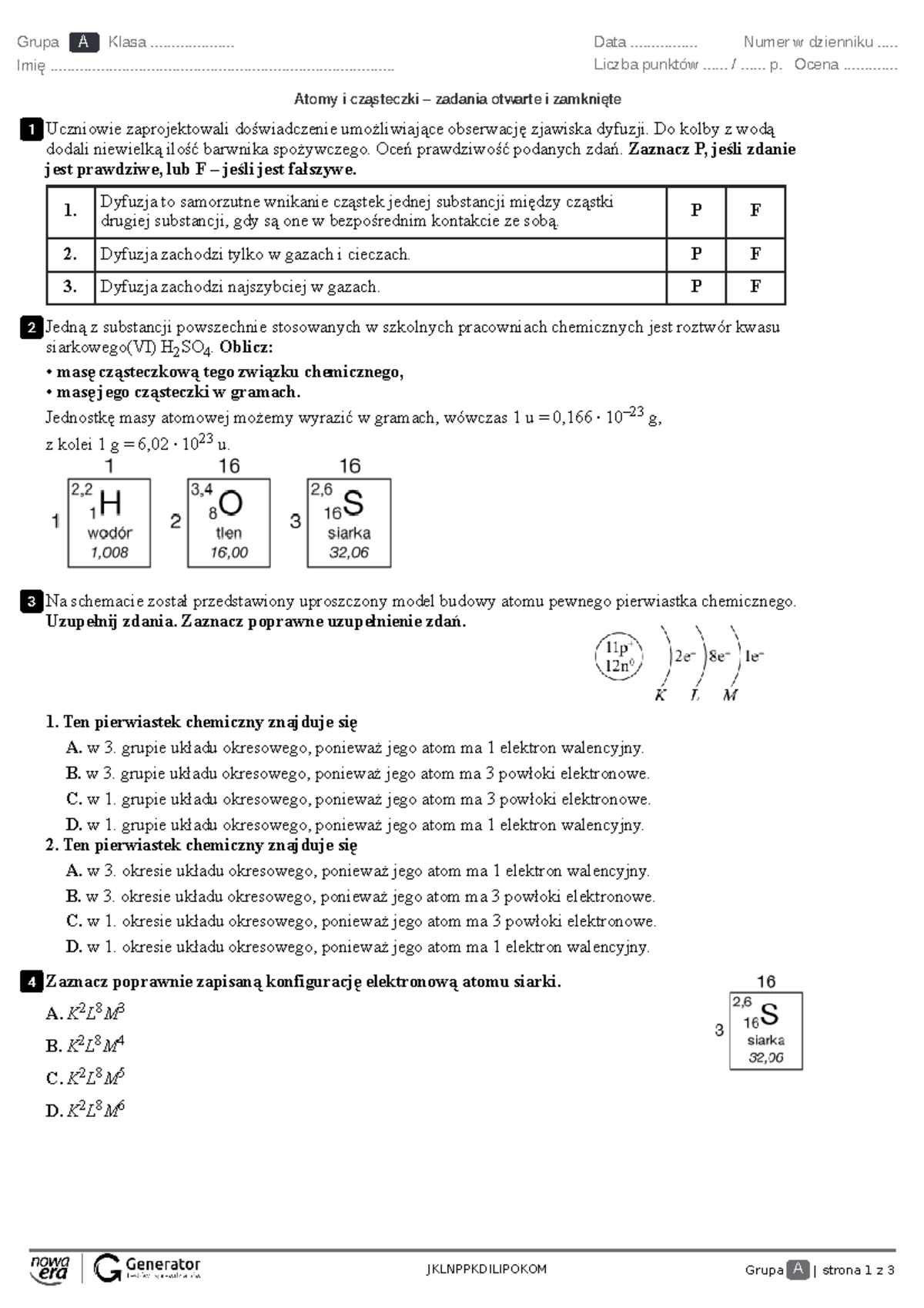
Zbliża się koniec drugiego semestru w gimnazjum, a wraz z nim dla wielu uczniów oznacza to jedno – nadchodzący sprawdzian z chemii. Jest to często moment, w którym zaczynamy intensywnie myśleć o tym, czego nauczyliśmy się przez ostatnie miesiące i jak przygotować się do tego ważnego egzaminu. Chemia, choć dla niektórych może wydawać się skomplikowana, jest fascynującą dziedziną, która otacza nas na co dzień, a jej zrozumienie otwiera drzwi do poznania wielu naturalnych procesów.
Ten sprawdzian to nie tylko test wiedzy, ale także okazja do podsumowania i utrwalenia materiału. Zrozumienie podstawowych zagadnień chemicznych jest kluczowe nie tylko dla dalszej edukacji, ale również dla świadomego życia w świecie pełnym substancji chemicznych, od tych w kuchni po te wykorzystywane w przemyśle.
Kluczowe Zagadnienia Sprawdzianu z II Semestru
Program drugiego semestru chemii w gimnazjum zazwyczaj koncentruje się na kilku fundamentalnych obszarach. Ich solidne opanowanie jest niezbędne do osiągnięcia sukcesu.
1. Stechiometria i Obliczenia Chemiczne
To bez wątpienia jeden z najważniejszych i najbardziej praktycznych działów. Stechiometria opiera się na prawach zachowania masy i stałości składu, które pozwalają na ilościowe przewidywanie wyników reakcji chemicznych. Zrozumienie pojęć takich jak masa molowa, mol, czy liczba Avogadra jest tu absolutnie kluczowe.
Nauka poprawnego bilansowania równań reakcji jest podstawą wszelkich obliczeń. Bez zbilansowanego równania nie możemy prawidłowo określić stosunków molowych reagentów i produktów. Przykładowo, reakcja syntezy wody:
2H2 + O2 → 2H2O
Informuje nas, że do otrzymania dwóch cząsteczek wody potrzebne są dwie cząsteczki wodoru i jedna cząsteczka tlenu. Z punktu widzenia stechiometrii, oznacza to, że 2 mole wodoru reagują z 1 molem tlenu, tworząc 2 mole wody.
Obliczenia często obejmują wyznaczanie masy substancji, objętości gazów w określonych warunkach (np. w warunkach normalnych – WN), czy też liczby moli. Możemy spotkać zadania typu: "Ile gramów tlenu potrzeba do całkowitego spalenia 16 gramów metanu (CH4)?". Rozwiązanie wymagałoby najpierw zbilansowania równania reakcji:
CH4 + 2O2 → CO2 + 2H2O
Następnie przeliczenia masy metanu na mole, wykorzystania stosunków molowych z równania do wyznaczenia liczby moli tlenu, a na końcu przeliczenia tej liczby moli na masę w gramach.
W praktyce, te umiejętności są nieocenione. Każdy przemysł chemiczny, od produkcji leków, przez tworzenie tworzyw sztucznych, po przygotowywanie nawozów, opiera się na precyzyjnych obliczeniach stechiometrycznych, aby zapewnić optymalne wykorzystanie surowców i uzyskać pożądane produkty w odpowiednich ilościach.
2. Roztwory i ich Właściwości
Kolejnym ważnym działem są roztwory – mieszaniny jednorodne, które odgrywają kluczową rolę w wielu procesach biologicznych i chemicznych. Zrozumienie pojęć takich jak rozpuszczalnik, substancja rozpuszczona, nasycenie, nienasycenie i przesycenie jest tutaj fundamentalne.
Szczególną uwagę zwraca się na stężenie roztworów. Najczęściej spotykane jednostki stężenia to stężenie procentowe masowe (% wagowy) oraz stężenie molowe (mol/dm3, czyli molarność). Stężenie procentowe informuje nas, ile gramów substancji rozpuszczonej znajduje się w 100 gramach roztworu. Na przykład, roztwór soli kuchennej o stężeniu 10% wagowo oznacza, że w 100g takiego roztworu mamy 10g NaCl i 90g wody.
Obliczenia związane ze stężeniami obejmują przygotowywanie roztworów o określonym stężeniu, rozcieńczanie roztworów, czy wyznaczanie ilości substancji rozpuszczonej w danej objętości lub masie roztworu. Przykładem może być zadanie: "Jak przygotować 500g roztworu NaCl o stężeniu 5% wagowym?". Wymaga to obliczenia masy NaCl (5% z 500g = 25g) i masy wody (500g - 25g = 475g).
W życiu codziennym mamy do czynienia z niezliczoną liczbą roztworów. Krew jest skomplikowanym roztworem wielu substancji, który transportuje tlen i składniki odżywcze. Leki często podawane są w formie roztworów, aby ułatwić ich wchłanianie. Nawet przygotowanie herbaty czy kawy to proces tworzenia roztworu.
3. Kwasy, Zasady i Sole
Ten dział wprowadza nas w świat nieorganicznych związków chemicznych, które odgrywają ogromną rolę w przyrodzie i technice. Zrozumienie ich budowy, właściwości i reakcji jest kluczowe.
Kwasy charakteryzują się obecnością jonów H+ w roztworze wodnym. Zasady (inaczej wodorotlenki) reagują z kwasami i często zawierają jony OH-. Szczególnie ważną reakcją jest neutralizacja, w której kwas reaguje z zasadą, tworząc sól i wodę.
Przykładowa reakcja neutralizacji: HCl (kwas solny) + NaOH (wodorotlenek sodu) → NaCl (chlorek sodu) + H2O (woda)
Sole to związki powstające w wyniku reakcji kwasu z zasadą. Wiele soli jest substancjami stałymi, krystalicznymi, które rozpuszczają się w wodzie. Ich rozpuszczalność jest ważną cechą, która wpływa na ich zastosowanie.
Wskaźniki kwasowo-zasadowe, takie jak lakmus czy fenoloftaleina, są niezwykle przydatne do określania charakteru kwasowego, zasadowego lub obojętnego roztworu. Ich zmiana barwy w zależności od pH jest prostym, ale skutecznym narzędziem diagnostycznym.
Przykłady z życia: Kwas cytrynowy w cytrusach nadaje im kwaśny smak. Wodorotlenek sodu (soda kaustyczna) jest silną zasadą, używaną do produkcji mydła i środków czyszczących (należy z nim postępować z wyjątkową ostrożnością!). Chlorek sodu, czyli zwykła sól kuchenna, jest solą, która jest niezbędna do życia i znajduje zastosowanie w konserwowaniu żywności.
Zrozumienie tej grupy związków pozwala na wyjaśnienie wielu zjawisk, od smaku potraw, przez działanie detergentów, po procesy zachodzące w organizmie.
4. Reakcje Utleniania i Redukcji (Redoks)
Ten dział wprowadza pojęcie stopnia utlenienia, które jest narzędziem do śledzenia przepływu elektronów w reakcjach chemicznych. Reakcje redoks są wszechobecne w przyrodzie i technice.
Wyróżniamy dwa typy procesów: utlenianie (utrata elektronów, wzrost stopnia utlenienia) i redukcję (przyjmowanie elektronów, spadek stopnia utlenienia). W każdej reakcji redoks musi zajść zarówno utlenianie, jak i redukcja.
Często spotykanym zadaniem jest ustalanie stopnia utlenienia dla poszczególnych pierwiastków w związkach i jonach, a następnie identyfikowanie substancji utleniającej i redukującej w reakcji.
Realne zastosowania reakcji redoks są imponujące. Procesy takie jak fotosynteza i oddychanie komórkowe są złożonymi reakcjami redoks, które dostarczają energię do życia. Rdza, czyli utlenianie żelaza, jest przykładem niepożądanego procesu redoks. Baterie i akumulatory działają na zasadzie kontrolowanych reakcji redoks, które generują prąd elektryczny. Odpalanie fajerwerków czy spalanie paliw również opiera się na tych reakcjach.
Zrozumienie mechanizmów redoks otwiera drogę do zrozumienia procesów energetycznych i elektrochemicznych.
Jak Skutecznie Przygotować się do Sprawdzianu?
Dobrze zorganizowana nauka to klucz do sukcesu. Oto kilka sprawdzonych metod:
- Systematyczność: Nie zostawiaj nauki na ostatnią chwilę. Regularne powtarzanie materiału pozwoli Ci utrwalić wiedzę. Codzienne krótsze sesje są często bardziej efektywne niż jedna długa sesja przed sprawdzianem.
- Zrozumienie, nie zapamiętywanie: Staraj się zrozumieć dlaczego coś działa w ten sposób, a nie tylko zapamiętać wzory i definicje. Chemia opiera się na logice.
- Rozwiązywanie zadań: Praktyka czyni mistrza. Rozwiązuj jak najwięcej zadań z podręcznika, zeszytu ćwiczeń, a także zadań z poprzednich lat, jeśli są dostępne. Szczególną uwagę zwracaj na zadania obliczeniowe.
- Tworzenie notatek i map myśli: Wizualizacja pomaga w porządkowaniu wiedzy. Stwórz własne notatki, podkreślając kluczowe pojęcia, rysując schematy reakcji.
- Praca w grupie: Uczenie się w grupie z kolegami może być bardzo pomocne. Możecie wzajemnie się tłumaczyć, sprawdzać i dyskutować nad trudniejszymi zagadnieniami.
- Korzystanie z dodatkowych materiałów: Jeśli coś jest niejasne, poszukaj informacji w dodatkowych podręcznikach, na stronach internetowych poświęconych chemii, czy też na platformach edukacyjnych.
- Konsultacje z nauczycielem: Nie bój się zadawać pytań nauczycielowi. On jest od tego, aby Ci pomóc. Wykorzystaj czas na lekcjach lub dyżury, aby wyjaśnić wątpliwości.
- Powtórka przed sprawdzianem: Dzień przed sprawdzianem poświęć na krótką powtórkę najważniejszych zagadnień, wzorów i definicji. Unikaj uczenia się nowego materiału.
Podsumowanie
Sprawdzian z drugiego semestru chemii w gimnazjum to ważny etap, który pozwala ocenić Twoje postępy. Zagadnienia takie jak stechiometria, roztwory, kwasy, zasady i sole, a także reakcje redoks stanowią fundament dalszej nauki chemii.
Pamiętaj, że chemia to nie tylko sucha teoria, ale również fascynujący świat, który można zaobserwować wokół siebie. Dobre przygotowanie, systematyczna praca i skupienie na zrozumieniu pomogą Ci osiągnąć sukces. Niech ten sprawdzian będzie dla Ciebie nie tylko wyzwaniem, ale także okazją do pogłębienia wiedzy i przekonania się, jak interesująca może być nauka o materii!






