Przykłady Na Sprawdzian Chemia Gimnazjum

Rozumiem, że przygotowania do sprawdzianu z chemii w gimnazjum potrafią być stresujące. Wiele osób zmaga się z abstrakcyjnym charakterem niektórych zagadnień, ogromem materiału czy specyficznym językiem, którym posługuje się chemia. Często słyszę od uczniów, że zadania sprawiają problem, a wykresy czy równania reakcji wydają się nie do rozszyfrowania. To zupełnie normalne! Chemia, choć logiczna, wymaga pewnego podejścia i strategicznego przygotowania. Chcę Wam pokazać, że z odpowiednimi narzędziami i strategią, sprawdzian z chemii może stać się okazją do wykazania się wiedzą i zrozumieniem, a nie źródłem niepokoju.
Kluczem do sukcesu jest systematyczność i praktyka. Im więcej będziemy ćwiczyć, tym pewniej poczujemy się z materiałem. Zamiast uczyć się wszystkiego na ostatnią chwilę, lepiej rozłożyć naukę w czasie. Warto też zrozumieć, że chemia to nie tylko zapamiętywanie, ale przede wszystkim rozumienie procesów.
Kluczowe Obszary i Przykładowe Zadania
Sprawdziany z chemii w gimnazjum zazwyczaj obejmują kilka fundamentalnych obszarów. Przyjrzyjmy się im bliżej i zobaczmy, jakie typowe zadania mogą się pojawić, wraz z krótkimi wskazówkami, jak sobie z nimi radzić.
1. Budowa Atomu i Układ Okresowy
To absolutna podstawa. Zrozumienie, jak zbudowany jest atom (protony, neutrony, elektrony), czym są liczby atomowe i masowe, a także jak działają grupy i okresy w układzie okresowym, jest niezbędne do dalszej nauki.
Przykładowe Zadanie:
Określ liczbę protonów, neutronów i elektronów w atomie sodu (Na), którego liczba atomowa wynosi 11, a liczba masowa 23.
Jak to rozwiązać?
- Liczba atomowa (Z) to zawsze liczba protonów. Czyli w atomie sodu jest 11 protonów.
- Liczba elektronów w atomie obojętnym jest równa liczbie protonów. Zatem mamy też 11 elektronów.
- Liczba masowa (A) to suma protonów i neutronów. Aby obliczyć liczbę neutronów, odejmujemy liczbę atomową (protony) od liczby masowej: A - Z = liczba neutronów. Czyli 23 - 11 = 12 neutronów.
Ważne wskazówki: Zawsze miej pod ręką układ okresowy pierwiastków. Zwracaj uwagę na liczby pod symbolami pierwiastków (liczba atomowa) i liczby nad nimi (liczba masowa – może się lekko różnić w zależności od izotopu, ale zazwyczaj podaje się wartość zaokrągloną lub najczęściej występującego izotopu).
2. Wiązania Chemiczne
Zrozumienie, jak atomy łączą się ze sobą, tworząc cząsteczki, jest kluczowe. Najczęściej omawiane są wiązania jonowe i kowalencyjne.
Przykładowe Zadanie:
Określ rodzaj wiązania chemicznego w związku chemicznym zbudowanym z sodu (Na) i chloru (Cl). Napisz wzór tego związku.
Jak to rozwiązać?
- Sód (Na) jest metalem, a chlor (Cl) jest niemetalem. Wiązanie między metalem a niemetalem zazwyczaj jest jonowe.
- Sód w układzie okresowym znajduje się w grupie 1, więc łatwo oddaje 1 elektron, tworząc jon Na+.
- Chlor znajduje się w grupie 17, więc potrzebuje 1 elektronu do uzyskania stabilnej konfiguracji, tworząc jon Cl-.
- Jon Na+ i jon Cl- przyciągają się elektrostatycznie, tworząc wiązanie jonowe.
- Wzór związku to NaCl (chlorek sodu, czyli sól kuchenna).
Ważne wskazówki: Zwracaj uwagę na położenie pierwiastków w układzie okresowym. Metale (zwykle po lewej stronie) łatwo oddają elektrony, niemetale (zwykle po prawej stronie) chętnie przyjmują elektrony. Wiązanie kowalencyjne występuje zazwyczaj między dwoma niemetalami, gdzie elektrony są współdzielone.
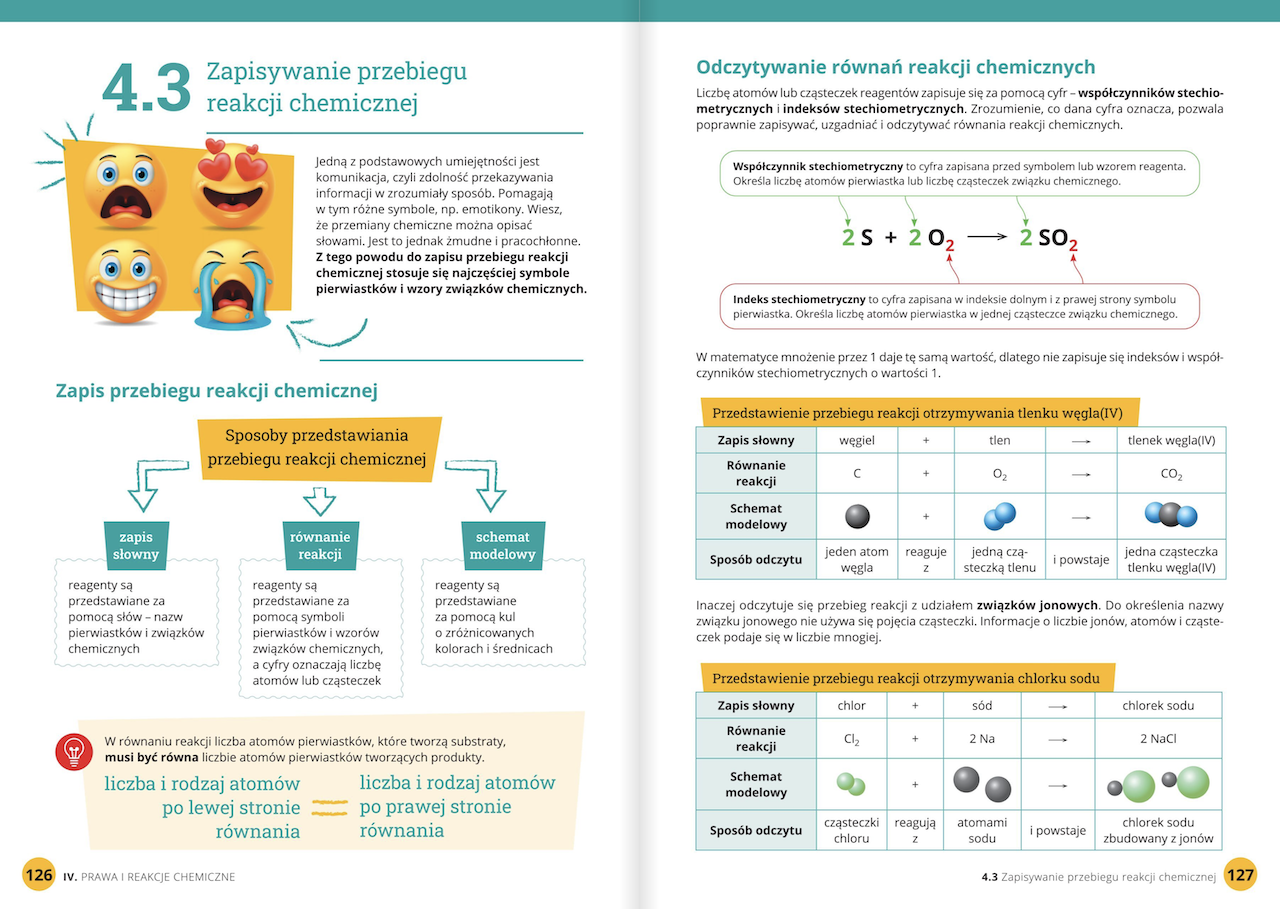
3. Reakcje Chemiczne i Równania Reakcji
To jeden z trudniejszych, ale i najbardziej fascynujących działów. Umiejętność rozpoznawania typów reakcji (np. synteza, analiza, wymiana) i bilansowanie równań jest niezwykle ważna.
Przykładowe Zadanie:
Zbilansuj poniższe równanie reakcji:
H2 + O2 → H2O
Jak to rozwiązać?
- Sprawdź, ile atomów każdego pierwiastka znajduje się po obu stronach równania. Po lewej stronie: 2 atomy H, 2 atomy O. Po prawej stronie: 2 atomy H, 1 atom O.
- Atom tlenu jest niezbilansowany. Aby mieć 2 atomy tlenu po prawej stronie, musimy postawić współczynnik stechiometryczny '2' przed cząsteczką wody: H2 + O2 → 2H2O.
- Teraz po prawej stronie mamy 2 atomy O, ale 4 atomy H (2 cząsteczki wody, każda z 2 atomami H).
- Aby zbilansować atomy wodoru po lewej stronie, musimy postawić współczynnik '2' przed cząsteczką wodoru: 2H2 + O2 → 2H2O.
- Sprawdźmy ponownie: Po lewej: 4 atomy H, 2 atomy O. Po prawej: 4 atomy H, 2 atomy O. Równanie jest zbilansowane!
Ważne wskazówki: Pamiętaj, że nie można zmieniać wzorów substancji (np. H2O2 zamiast H2O), a jedynie dodawać współczynniki stechiometryczne przed całymi cząsteczkami. Zacznij od pierwiastków, które występują tylko w jednej cząsteczce po każdej stronie równania. Tlen i wodór często zostawia się na koniec.
4. Wzory Sumaryczne i Strukturalne
Umiejętność zapisywania wzorów substancji, zarówno sumarycznych (pokazujących skład pierwiastkowy), jak i strukturalnych (pokazujących sposób połączenia atomów), jest kluczowa.
Przykładowe Zadanie:
Napisz wzór sumaryczny i narysuj wzór strukturalny cząsteczki metanu.
Jak to rozwiązać?
- Metan to najprostszy węglowodór. Jego nazwa wskazuje na obecność jednego atomu węgla (met-).
- Węgiel w związkach organicznych jest zazwyczaj czterowartościowy, co oznacza, że tworzy 4 wiązania.
- W cząsteczce metanu jeden atom węgla jest połączony z czterema atomami wodoru.
- Wzór sumaryczny: CH4.
- Wzór strukturalny: Atom węgla w centrum, otoczony czterema atomami wodoru, z których każdy tworzy z węglem pojedyncze wiązanie. Można to przedstawić jako krzyż z atomem węgla w środku.
Ważne wskazówki: Zwracaj uwagę na wartościowość pierwiastków. Węgiel zazwyczaj jest czterowartościowy, tlen dwuwartościowy, wodór jednowartościowy, azot trójwartościowy (w podstawowych związkach).
5. Rozpuszczalność i Roztwory
Ten dział dotyczy tego, jak substancje zachowują się w wodzie i jak opisać te procesy.
Przykładowe Zadanie:
W 100 g wody rozpuszczono 30 g cukru. Oblicz stężenie procentowe otrzymanego roztworu.
Jak to rozwiązać?
- Stężenie procentowe (% cp) obliczamy ze wzoru: % cp = (masa substancji rozpuszczonej / masa roztworu) * 100%
- Masa substancji rozpuszczonej (cukru) = 30 g.
- Masa roztworu to suma masy substancji rozpuszczonej i masy rozpuszczalnika (wody): Masa roztworu = 30 g + 100 g = 130 g.
- Teraz podstawiamy do wzoru: % cp = (30 g / 130 g) * 100% ≈ 23,08%.
Ważne wskazówki: Dokładnie czytaj treść zadania! Czasem podana jest masa substancji i masa rozpuszczalnika, a czasem masa substancji i masa całego roztworu. Masa roztworu ≠ masa rozpuszczalnika, chyba że masa substancji rozpuszczonej jest zaniedbywalnie mała.
Strategie Skutecznej Nauki
Oprócz zrozumienia typowych zagadnień, warto przyjąć pewne strategie uczenia się, które pomogą Wam przygotować się do sprawdzianu.
- Twórz Mapy Myśli: Wizualizuj powiązania między zagadnieniami. Mapa myśli dla budowy atomu może zawierać podpunkty dotyczące protonów, neutronów, elektronów, liczb atomowej i masowej, powiązane z układem okresowym.
- Używaj Fiszek: Świetne do zapamiętywania wzorów, definicji czy symboli pierwiastków. Jedna strona – pytanie, druga – odpowiedź.
- Rozwiązuj Jak Najwięcej Zadań: To najlepszy sposób na utrwalenie wiedzy. Ćwiczenia praktyczne budują pewność siebie i pozwalają wychwycić luki w wiedzy. Korzystaj z podręczników, zbiorów zadań, a także z zadań z poprzednich lat, jeśli są dostępne.
- Wyjaśniaj Innym: Tłumaczenie zagadnień koledze czy koleżance to doskonały sposób na sprawdzenie własnego zrozumienia. Jeśli potrafisz coś wytłumaczyć prostymi słowami, znaczy, że to rozumiesz.
- Powtarzaj Regularnie: Krótkie, ale częste powtórki są znacznie skuteczniejsze niż jedna długa sesja nauki przed sprawdzianem. Metoda "spaced repetition" (powtarzanie w odstępach czasowych) jest bardzo efektywna.
- Zrozum Pojęcia, Nie Tylko Zapamiętuj: Zamiast wkuwać na pamięć wzory, staraj się zrozumieć, dlaczego dany wzór wygląda tak, a nie inaczej. Co stoi za danym zjawiskiem? Jakie są zasady rządzące danym procesem? Badania w dziedzinie edukacji, takie jak prace Jeroma Brunera czy Davida Ausubela, podkreślają znaczenie nauczania opartego na zrozumieniu i konstruowaniu wiedzy przez ucznia.
Rola Nauczyciela i Rodzica
Nauczyciele odgrywają kluczową rolę w przygotowaniu uczniów. Powinni zapewniać jasne instrukcje, różnorodne metody nauczania i możliwość zadawania pytań. Rodzice natomiast mogą wspierać swoje dzieci, tworząc spokojne środowisko do nauki, motywując i pomagając w organizacji czasu. Współpraca między domem a szkołą jest nieoceniona.
Pamiętajcie, że każdy uczeń ma swoje tempo nauki. Jeśli jakieś zagadnienie sprawia Wam trudność, nie poddawajcie się. Dajcie sobie czas, szukajcie dodatkowych materiałów, pytajcie nauczyciela. Wasze wysiłki na pewno przyniosą rezultaty. Z każdym kolejnym rozwiązaniem zadania, z każdym zrozumianym pojęciem, budujecie swoją wiedzę i pewność siebie. Sprawdzian to tylko jedno z wielu narzędzi oceny, a prawdziwym celem jest zdobycie solidnych podstaw, które przydadzą się Wam nie tylko w szkole, ale i w przyszłości.
Wiem, że macie w sobie potencjał, by osiągnąć sukces. Z odpowiednim podejściem i determinacją, sprawdzian z chemii może stać się dowodem Waszych umiejętności. Powodzenia!