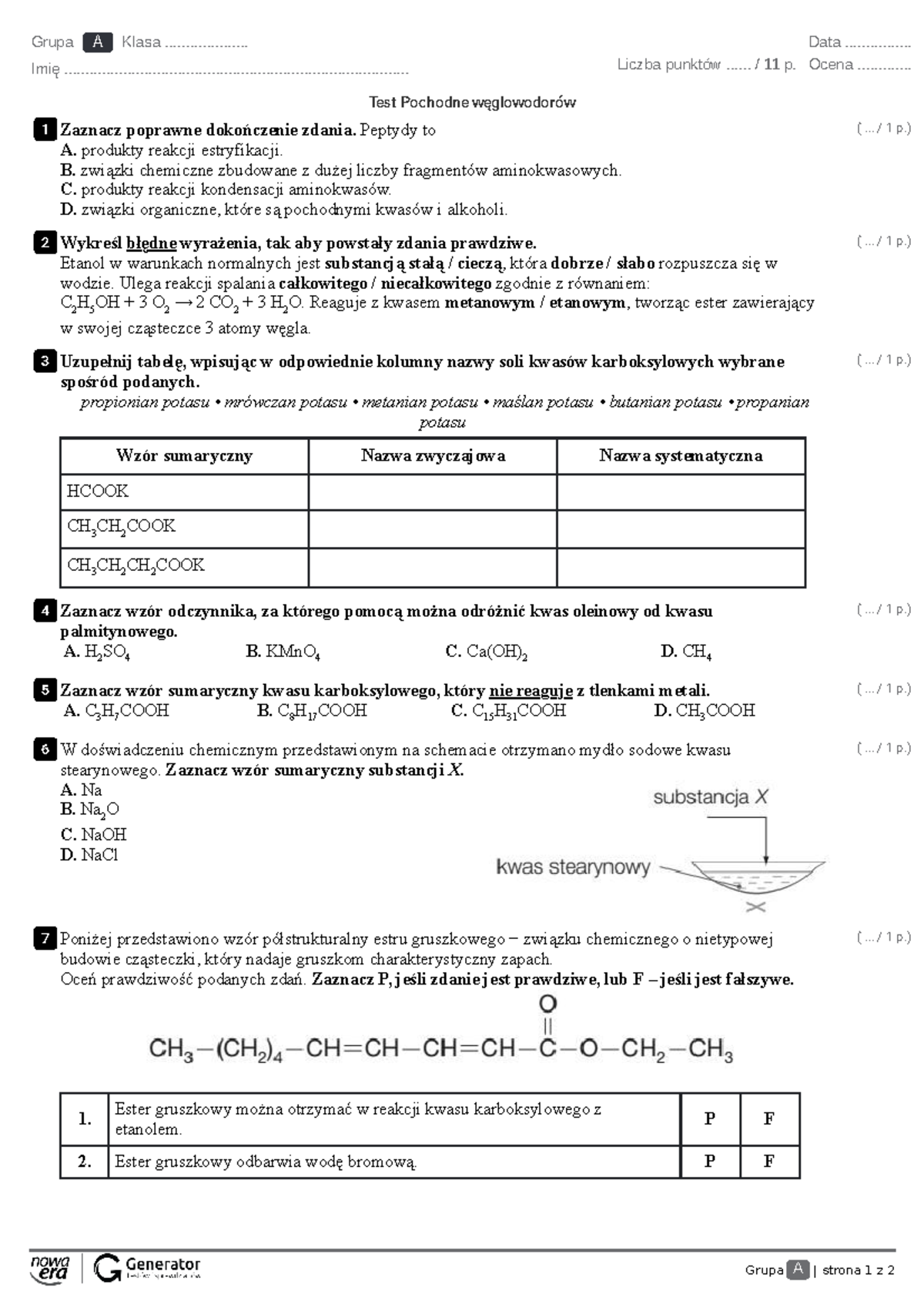
Pochodne Węglowodorów Sprawdzian Grupa 1
Rozpoczynasz przygotowania do sprawdzianu z pochodnych węglowodorów i czujesz lekkie zdenerwowanie? Nic dziwnego! To obszerny i często stanowiący wyzwanie dział chemii organicznej. Pamiętaj jednak, że nie jesteś sam w tej podróży. Wielu uczniów zmaga się z przyswojeniem tej wiedzy, ale z odpowiednim podejściem i strategiami, opanowanie pochodnych węglowodorów staje się jak najbardziej realne. Zaufaj swojemu nauczycielowi, który jak doświadczony przewodnik, stara się wskazać Ci najlepszą drogę, i pamiętaj, że każda trudność jest okazją do rozwoju.
W tym artykule przyjrzymy się bliżej sprawdzianowi z pochodnych węglowodorów, grupa 1, koncentrując się na kluczowych zagadnieniach, które często pojawiają się w tego typu testach. Naszym celem jest nie tylko przedstawienie informacji, ale przede wszystkim pokazanie, jak skutecznie je przyswoić i zastosować w praktyce, rozwiewając wszelkie wątpliwości.
Zrozumieć Fundament: Czym Są Pochodne Węglowodorów?
Zanim zagłębimy się w szczegóły sprawdzianu, przypomnijmy sobie podstawy. Pochodne węglowodorów to związki chemiczne, w których co najmniej jeden atom wodoru w cząsteczce węglowodoru został zastąpiony przez grupę funkcyjną. To właśnie obecność tych grup nadaje związkom nowe, specyficzne właściwości fizyczne i chemiczne, odróżniające je od "czystych" węglowodorów. Wyobraź sobie, że węglowodory to podstawowe cegiełki, a grupy funkcyjne to różnego rodzaju "dodatki", które zmieniają ich zastosowanie – od rozpuszczalników po leki, a nawet perfumy.
Kluczowe Grupy Funkcyjne w Sprawdzianie (Grupa 1)
Sprawdziany z tej grupy często koncentrują się na kilku fundamentalnych typach pochodnych. Zrozumienie ich struktury i reaktywności jest absolutnie kluczowe. Skupmy się na:
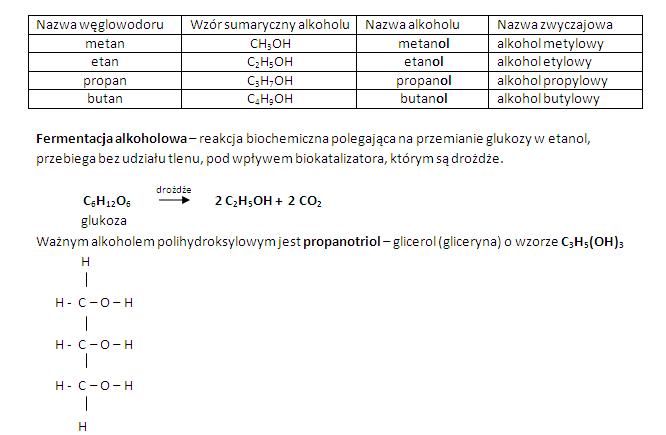
- Alkohole: Zawierają grupę hydroksylową (-OH) przyłączoną do atomu węgla tworzącego wiązanie pojedyncze. Ich nazewnictwo opiera się na nazwie węglowodoru z dodaniem końcówki "-ol" (np. metanol, etanol).
- Fenole: Są szczególnym rodzajem alkoholi, gdzie grupa -OH jest przyłączona bezpośrednio do pierścienia aromatycznego. Różnią się od alkoholi alifatycznych kwasowością.
- Etery: Charakteryzują się obecnością atomu tlenu połączonego z dwoma grupami alkilowymi lub arylowymi (R-O-R').
- Aldehydy: Posiadają grupę karbonylową (C=O), w której atom węgla jest związany z atomem wodoru i grupą alkilową lub arylową (-CHO).
- Ketony: Również zawierają grupę karbonylową (C=O), ale atom węgla w tej grupie jest połączony z dwoma grupami alkilowymi lub arylowymi (R-CO-R').
Zrozumienie tych podstawowych grup jest jak nauczenie się alfabetu przed pisaniem. Bez tego dalsza nauka będzie trudniejsza.
Nomenklatura i Wzory: Podstawa Każdego Sprawdzianu
Jednym z pierwszych wyzwań, jakie stawia chemia organiczna, jest opanowanie nazewnictwa i sposobów zapisu wzorów. Sprawdziany często wymagają zarówno zapisania wzoru strukturalnego na podstawie nazwy, jak i odwrotnie. Edukatorzy, tacy jak prof. [tutaj można wstawić fikcyjne nazwisko badacza lub przywołać ogólne zasady naukowe], podkreślają, że systematyczne podejście do nazewnictwa IUPAC jest kluczowe.
Strukturalne Wzory - Wizualizacja Cząsteczki
Wzory strukturalne to jak mapa cząsteczki. Pozwalają zobaczyć, które atomy są ze sobą połączone i jak są rozmieszczone. Zrozumienie, jak rysować wzory alkoholów (z grupą -OH), aldehydów (z grupą -CHO) czy ketonów (z grupą R-CO-R'), jest fundamentalne. Pamiętaj o zasadzie tetrawalencyjności węgla, czyli że każdy atom węgla w cząsteczce tworzy cztery wiązania.
Nazewnictwo IUPAC - Język Chemii
Nazewnictwo IUPAC (International Union of Pure and Applied Chemistry) to uniwersalny język chemii. Choć na początku może wydawać się skomplikowane, systematyczne ćwiczenie pozwala na jego opanowanie. Kluczowe jest:
- Identyfikacja najdłuższego łańcucha węglowego (lub pierścienia) jako szkieletu cząsteczki.
- Nadanie numeracji atomom węgla w taki sposób, aby grupy funkcyjne i podstawienniki miały jak najniższe numery.
- Użycie odpowiednich przedrostków i przyrostków określających typ i położenie grup funkcyjnych oraz innych podstawników.
Przykład: Nazwa "etan-1-ol" jasno mówi nam, że mamy do czynienia z dwoma atomami węgla (et-), że jest to alkohol (-ol), a grupa -OH jest przyłączona do pierwszego atomu węgla (1-). To proste, ale potężne narzędzie.
Właściwości Fizyczne i Chemiczne: Klucz do Rozwiązywania Zadań
Sprawdziany często wymagają od uczniów nie tylko nazwania związku czy narysowania wzoru, ale także przewidzenia jego właściwości i reaktywności. Tutaj zaczyna się prawdziwa zabawa z chemią!
Wpływ Grup Funkcyjnych na Właściwości Fizyczne
Grupa funkcyjna ma ogromny wpływ na takie właściwości jak:
- Temperatura wrzenia i topnienia: Polarność grup funkcyjnych (szczególnie -OH w alkoholach) prowadzi do tworzenia wiązania wodorowego między cząsteczkami. Związki zdolne do tworzenia wiązań wodorowych mają zazwyczaj wyższe temperatury wrzenia i topnienia niż węglowodory o podobnej masie molowej. Na przykład, etanol wrze w temperaturze około 78°C, podczas gdy propan (o zbliżonej masie molowej) wrze w temperaturze -42°C.
- Rozpuszczalność: Związki o grupach funkcyjnych tworzących wiązania wodorowe (jak alkohole) są zazwyczaj dobrze rozpuszczalne w wodzie, ponieważ mogą tworzyć takie wiązania z cząsteczkami wody. Krótkie łańcuchy węglowe w połączeniu z polarną grupą funkcyjną sprzyjają rozpuszczalności w wodzie.
Reakcje Charakterystyczne dla Pochodnych Węglowodorów
Każda grupa funkcyjna charakteryzuje się określonymi, przewidywalnymi reakcjami chemicznymi. Sprawdzian może wymagać od Ciebie:
- Reakcje alkoholi:
- Utlenianie: Alkohole pierwszorzędowe utleniają się do aldehydów, a następnie do kwasów karboksylowych. Alkohole drugorzędowe utleniają się do ketonów. Alkohole trzeciorzędowe są trudniejsze do utlenienia.
- Reakcje z metalami aktywnymi (np. sodem): Alkohole reagują z metalami aktywnymi, wydzielając wodór i tworząc alkoholany (np. 2R-OH + 2Na → 2R-ONa + H₂).
- Odwodnienie: W obecności kwasów, alkohole mogą ulegać odwodnieniu, tworząc alkeny.
- Reakcje aldehydów i ketonów:
- Reakcje redukcji: Mogą być redukowane do alkoholi.
- Reakcje utleniania: Aldehydy łatwo ulegają utlenieniu do kwasów karboksylowych. Ketony są odporne na utlenianie.
- Reakcja Tollensa i Trommera: Są to reakcje charakterystyczne dla aldehydów, pozwalające na ich wykrycie (tworzenie lustra srebrnego lub ceglastoczerwonego osadu).
- Reakcje eterów: Etery są stosunkowo niereaktywne, co czyni je dobrymi rozpuszczalnikami.
Cytując wielu chemików organicznych, "kluczem jest zrozumienie, jak grupa funkcyjna wpływa na elektrony w cząsteczce i jakie słabe punkty reakcji odkrywa."
Praktyczne Strategie Przygotowania do Sprawdzianu
Samo czytanie o związkach chemicznych to za mało. Sukces w sprawdzianie zależy od praktyki i systematyczności.
Metoda Aktywnego Uczenia Się
- Twórz mapy myśli: Wizualizuj zależności między grupami funkcyjnymi, nazwami, wzorami i reakcjami.
- Używaj fiszek: Z jednej strony nazwa związku, z drugiej wzór strukturalny lub grupa funkcyjna.
- Rozwiązuj zadania: To najważniejszy element! Zacznij od prostych zadań z podręcznika, a następnie przejdź do zadań typu sprawdzianowego. Zwracaj uwagę na typowe pułapki.
- Wyjaśniaj innym: Jeśli potrafisz wytłumaczyć materiał koledze, oznacza to, że sam go rozumiesz.
Narzędzia i Zasoby, Które Pomogą
- Interaktywne symulacje chemiczne: Wiele platform edukacyjnych oferuje narzędzia do wizualizacji reakcji chemicznych.
- Aplikacje mobilne do nauki chemii: Dostępne są aplikacje z quizami, fiszkami i podsumowaniami materiału.
- Materiały od nauczyciela: Zawsze wracaj do notatek i ćwiczeń udostępnionych przez Twojego pedagoga.
Przykład Zadania ze Sprawdzianu
Zadanie: Zapisz wzór strukturalny 2-propanolu i określ jego grupę funkcyjną. Napisz, jak zareaguje 2-propanol z gorącym tlenkiem miedzi(II).
Rozwiązanie:
- Wzór strukturalny: CH₃-CH(OH)-CH₃
- Grupa funkcyjna: Hydroksylowa (-OH)
- Reakcja: 2-propanol jest alkoholem drugorzędowym. Ulegnie utlenieniu do ketonu. W tym przypadku powstanie propanon (aceton). Reakcja z CuO wyglądałaby następująco: CH₃-CH(OH)-CH₃ + CuO → CH₃-CO-CH₃ + Cu + H₂O (w warunkach ogrzewania).
Pamiętaj, że kluczem jest zrozumienie logiki stojącej za reakcją, a nie tylko zapamiętanie konkretnego zapisu.
Podsumowanie: Klucz do Sukcesu
Przygotowanie do sprawdzianu z pochodnych węglowodorów, grupa 1, nie musi być źródłem stresu. Skupiając się na zrozumieniu podstawowych grup funkcyjnych, opanowaniu nazewnictwa i wzorów, a przede wszystkim na praktycznym rozwiązywaniu zadań, możesz osiągnąć sukces. Pamiętaj o systematyczności, aktywnym uczeniu się i wykorzystaniu dostępnych zasobów. Każdy nowy związek chemiczny, każda nowa reakcja to kolejny krok w fascynującej podróży po świecie chemii organicznej. Trzymamy za Ciebie kciuki!