Co Wiedziec Na Sprawdzian Z Chemii Kwasy

Rozumiemy, że perspektywa sprawdzianu z chemii może budzić niepokój. Szczególnie gdy pojawia się temat kwasów – substancji, które wydają się wszechobecne, a jednocześnie potrafią być zdradliwe w swojej reaktywności. Wielu z Was czuje presję, zastanawiając się, czy wystarczająco dobrze zrozumieliście te skomplikowane zagadnienia. Spokojnie, nie jesteście sami w tym wyzwaniu. Celem tego artykułu jest rozwianie Waszych wątpliwości i przekazanie Wam kluczowej wiedzy, która pomoże Wam pewnie stawić czoła sprawdzianowi.
Kluczowa Wiedza o Kwasach na Sprawdzian
Chemia kwasów to nie tylko abstrakcyjne definicje i wzory. To dziedzina, która ma bezpośredni wpływ na nasze codzienne życie, często w sposób, którego nie dostrzegamy na pierwszy rzut oka.
Realny Wpływ Kwasów w Naszym Świecie
Zastanawialiście się kiedyś, dlaczego cytryna jest kwaśna? Albo dlaczego ocet służy do konserwowania żywności? To wszystko zasługa kwasów! Kwas cytrynowy w owocach nadaje im charakterystyczny smak, a kwas octowy w occie działa antybakteryjnie. Ale to dopiero początek. Nasz żołądek potrzebuje kwasu solnego (HCl) do trawienia pokarmu – bez niego proces ten byłby niemożliwy. W przemyśle kwas siarkowy (H₂SO₄) jest jednym z najczęściej produkowanych chemikaliów na świecie, używanym w produkcji nawozów, tworzyw sztucznych, a nawet baterii samochodowych. Kwas fosforowy (H₃PO₄) znajdziemy w napojach gazowanych (choć w niewielkich ilościach), a także w detergentach.
Ale z kwasami trzeba obchodzić się ostrożnie. Silne kwasy, takie jak kwas azotowy (HNO₃) czy kwas solny, mogą być niebezpieczne. Powodują poważne oparzenia skóry, niszczą materiały, a ich opary mogą być szkodliwe dla układu oddechowego. Dlatego tak ważne jest, aby znać ich właściwości i zasady bezpiecznego obchodzenia się z nimi.
Definicje i Podstawowe Właściwości Kwasów
Na sprawdzianie z pewnością pojawi się pytanie o definicję kwasu. Istnieje kilka podejść, które warto znać:
- Definicja Arrheniusa: Kwas to substancja, która w roztworze wodnym dysocjuje, uwalniając jony wodorowe (H⁺). To najbardziej podstawowa i historyczna definicja.
- Definicja Brønsteda-Lowry'ego: Kwas to cząsteczka lub jon, który oddaje proton (H⁺). Ta definicja jest szersza i obejmuje również reakcje w innych rozpuszczalnikach niż woda.
- Definicja Lewisa: Kwas to substancja, która może przyjmować parę elektronową. Jest to najszersza definicja, obejmująca nawet reakcje, w których nie występuje wodór.
Choć definicje te wydają się różne, często uzupełniają się i pozwalają lepiej zrozumieć naturę kwasów. Na potrzeby sprawdzianu, zazwyczaj skupiacie się na pierwszych dwóch definicjach, z naciskiem na obecność jonu H⁺ w roztworze jako kluczowy czynnik kwasowości.
Kluczowe Właściwości Kwasów, Które Musisz Zapamiętać
- Smak: Kwasy zazwyczaj mają kwaśny smak (choć nigdy nie wolno próbować nieznanych substancji chemicznych, aby to potwierdzić!).
- Reakcja z metalami: Wiele kwasów reaguje z metalami aktywnymi (np. magnez, cynk), tworząc sole i wydzielając wodór. Na przykład: 2HCl + Mg → MgCl₂ + H₂. Pamiętaj, że metale szlachetne (złoto, platyna) są odporne na działanie większości kwasów.
- Reakcja z zasadami (neutralizacja): Kwasy reagują z zasadami, tworząc sole i wodę. Jest to reakcja neutralizacji, która jest bardzo ważna w chemii i ma praktyczne zastosowania (np. w leczeniu zgagi). HCl + NaOH → NaCl + H₂O.
- Reakcja ze wskaźnikami: Kwasy zmieniają barwę wskaźników kwasowo-zasadowych. Na przykład, lakmus w środowisku kwasowym zmienia barwę na czerwoną, a fenoloftaleina pozostaje bezbarwna.
- Przewodnictwo elektryczne: Roztwory kwasów w wodzie dobrze przewodzą prąd elektryczny, ponieważ zawierają jony.
Siła Kwasów: Mocne i Słabe Kwasy
Nie wszystkie kwasy są sobie równe. Ich siła zależy od tego, jak łatwo dysocjują w wodzie, czyli jak chętnie oddają protony. Jest to fundamentalne rozróżnienie, które często stanowi sedno pytań sprawdzających.
Dysocjacja Jonowa – Klucz do Rozumienia Siły
Dysocjacja jonowa to proces, w którym cząsteczka kwasu rozpada się na jony w obecności rozpuszczalnika (najczęściej wody). Kwasy dzielimy na:
- Kwasy mocne: Dysocjują w wodzie niemal całkowicie. Oznacza to, że w ich roztworach dominuje forma zdysocjowana (jony). Przykłady: kwas solny (HCl), kwas siarkowy (VI) (H₂SO₄), kwas azotowy (V) (HNO₃). Reakcja dysocjacji mocnego kwasu jest zazwyczaj przedstawiana jako jednokierunkowa strzałka: HCl → H⁺ + Cl⁻.
- Kwasy słabe: Dysocjują w wodzie tylko częściowo. W ich roztworach obok jonów obecna jest również znaczna ilość niezdysocjowanych cząsteczek kwasu. Proces ten jest odwracalny i przedstawiany jako równowaga: CH₃COOH ⇌ H⁺ + CH₃COO⁻ (kwas octowy). Przykłady: kwas octowy (CH₃COOH), kwas węglowy (H₂CO₃), kwas siarkowy (IV) (H₂SO₃).
Ważna uwaga: Często spotykam się z pytaniami, czy można nazwać mocny kwas "agresywnym", a słaby "łagodnym". Choć takie określenia mogą być intuicyjne, w chemii stosujemy precyzyjne terminy: mocny/słaby w odniesieniu do stopnia dysocjacji, a żrący/nieżrący lub niebezpieczny/bezpieczny w odniesieniu do jego właściwości fizycznych i wpływu na organizm lub materiały. Mocny kwas nie zawsze musi być bardziej żrący niż słaby, choć często tak bywa. Na przykład, stężony kwas octowy (słaby kwas) może być bardziej drażniący niż bardzo rozcieńczony kwas solny (mocny kwas).
Skala pH – Uniwersalny Miernik Kwasowości
pH to logarytmiczna skala mierząca stężenie jonów hydroniowych (H₃O⁺), które w roztworach wodnych są formą jonów H⁺. Jest to niezwykle ważne pojęcie:
- pH < 7: Roztwór jest kwaśny. Im niższe pH, tym większe stężenie jonów H⁺ i tym silniejszy kwas.
- pH = 7: Roztwór jest obojętny (np. czysta woda).
- pH > 7: Roztwór jest zasadowy.
Pamiętajcie, że zmiana pH o 1 jednostkę oznacza dziesięciokrotną zmianę stężenia jonów H⁺. Czyli roztwór o pH 3 jest dziesięć razy bardziej kwaśny niż roztwór o pH 4 i sto razy bardziej kwaśny niż roztwór o pH 5.
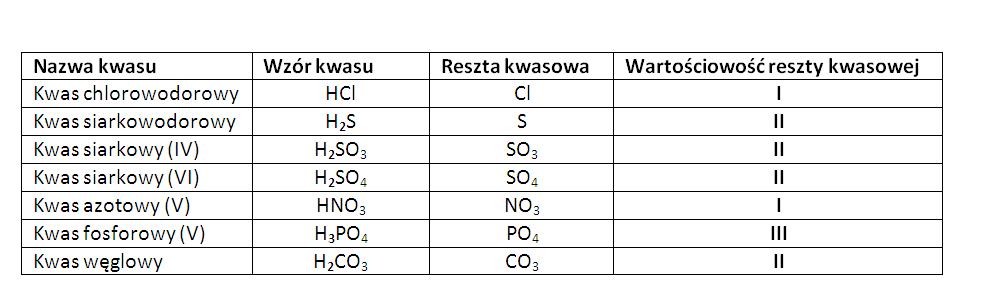
Nazewnictwo Kwasów – Klucz do Identyfikacji
Poprawne nazewnictwo kwasów jest kluczowe, aby móc je odróżnić i zrozumieć ich strukturę. Istnieją dwie główne grupy kwasów, które rządzą się nieco innymi zasadami:
Kwasy Beztlenowe
Są to kwasy zbudowane z wodoru i jednego pierwiastka niemetalicznego. Nazwy tworzymy poprzez dodanie przyrostka "-wodorowy" do nazwy pierwiastka. Przykłady:
- H₂S – kwas siarkowodorowy
- HCl – kwas chlorowodorowy
- HBr – kwas bromowodorowy
- HI – kwas jodowodorowy
- HF – kwas fluorowodorowy (uwaga: ten kwas jest szczególnie niebezpieczny i wymaga szczególnej ostrożności!)
Kwasy Tlenowe (Oksokwasy)
Są to kwasy zawierające wodór, tlen i atom centralnego niemetalu. Nazwy tworzymy od nazwy pierwiastka centralnego z dodaniem przyrostków "-owy" lub "-ny", zależnie od stopnia utlenienia pierwiastka.
- Pierwiastek o wyższym stopniu utlenienia: przyrostek "-owy" lub "-ny" (np. siarkowy, azotowy, fosforowy).
- Pierwiastek o niższym stopniu utlenienia: przyrostek "-awy" (np. siarkawy, azotawy).
Przykłady:
- H₂SO₄ – kwas siarkowy(VI) (siarka ma stopień utlenienia +VI)
- H₂SO₃ – kwas siarkawy(IV) (siarka ma stopień utlenienia +IV)
- HNO₃ – kwas azotowy(V) (azot ma stopień utlenienia +V)
- HNO₂ – kwas azotawy(III) (azot ma stopień utlenienia +III)
- H₃PO₄ – kwas fosforowy(V) (fosfor ma stopień utlenienia +V)
- H₂CO₃ – kwas węglowy (węgiel ma stopień utlenienia +IV)
Klucz do zapamiętania: Nazewnictwo jest ściśle powiązane ze stopniem utlenienia centralnego atomu. Jeśli nie pamiętacie stopnia utlenienia, sprawdźcie go na podstawie wzoru kwasu.
Jak Przygotować Się do Sprawdzianu? Praktyczne Wskazówki
Skoro już znamy teorię, czas przejść do praktyki. Jak skutecznie przygotować się do sprawdzianu z kwasów?
Metody Nauki, Które Działają
- Powtórz definicje: Upewnijcie się, że rozumiecie definicje Arrheniusa, Brønsteda-Lowry'ego i Lewisa. Zwróćcie uwagę na kluczowe pojęcia: proton (H⁺), jon wodorowy, donor protonu, akceptor pary elektronowej.
- Zrozum właściwości: Nie uczcie się na pamięć, ale zrozumcie, dlaczego kwasy reagują z metalami, dlaczego zachodzi neutralizacja, jak działają wskaźniki. Postarajcie się znaleźć przykłady z życia codziennego dla każdej właściwości.
- Ćwicz obliczenia pH: Jeśli na sprawdzianie pojawiają się obliczenia pH, musicie opanować podstawy. Zrozumcie, jak obliczyć pH z podanego stężenia jonów H⁺ i odwrotnie. Pamiętajcie o logarytmach!
- Zrozum dysocjację: Rozróżnienie między kwasami mocnymi a słabymi jest kluczowe. Umieć wymienić przykłady obu typów kwasów i zrozumieć, co oznacza zapis reakcji dysocjacji (strzałka jednokierunkowa vs. dwukierunkowa).
- Nazewnictwo – praktyka czyni mistrza: Sporządźcie listę kwasów, które pojawiły się na lekcjach, i ćwiczcie ich nazewnictwo. Spróbujcie napisać wzór, mając podaną nazwę, i odwrotnie. Zwracajcie uwagę na stopnie utlenienia.
- Rozwiązuj zadania: Najlepszym sposobem na utrwalenie wiedzy jest rozwiązywanie zadań. Korzystajcie z podręcznika, zeszytu ćwiczeń, zadań od nauczyciela. Zwracajcie uwagę na typy zadań, które sprawiają Wam najwięcej trudności.
- Wykorzystaj analogie: Jeśli pewne pojęcia są dla Was trudne, spróbujcie znaleźć proste analogie. Na przykład, kwas mocny jak bardzo otwarty kran – woda (jony) cieknie z niego obficie i szybko. Kwas słaby jak kran z małym przeciekiem – woda (jony) cieknie powoli i w niewielkich ilościach, większość wody pozostaje w kranie (niezdysocjowane cząsteczki).
Czego Unikać?
- Uczenia się tylko na pamięć: Chemia wymaga zrozumienia procesów, a nie tylko zapamiętania faktów.
- Ignorowania trudnych zagadnień: Jeśli czegoś nie rozumiecie, nie odpuszczajcie. Poproście o pomoc nauczyciela lub kolegów.
- Stresu przed sprawdzianem: Dobra organizacja nauki i pewność siebie to klucz do sukcesu.
Pamiętajcie, że każdy z Was ma potencjał, aby opanować ten materiał. Kluczem jest systematyczność i aktywne uczenie się. Kwasy to fascynująca dziedzina chemii, która otwiera drzwi do zrozumienia wielu zjawisk otaczających nas w świecie.
Czy czujecie się teraz pewniej w kwestii przygotowań do sprawdzianu z kwasów? Jakie zagadnienia nadal budzą Wasze największe wątpliwości?