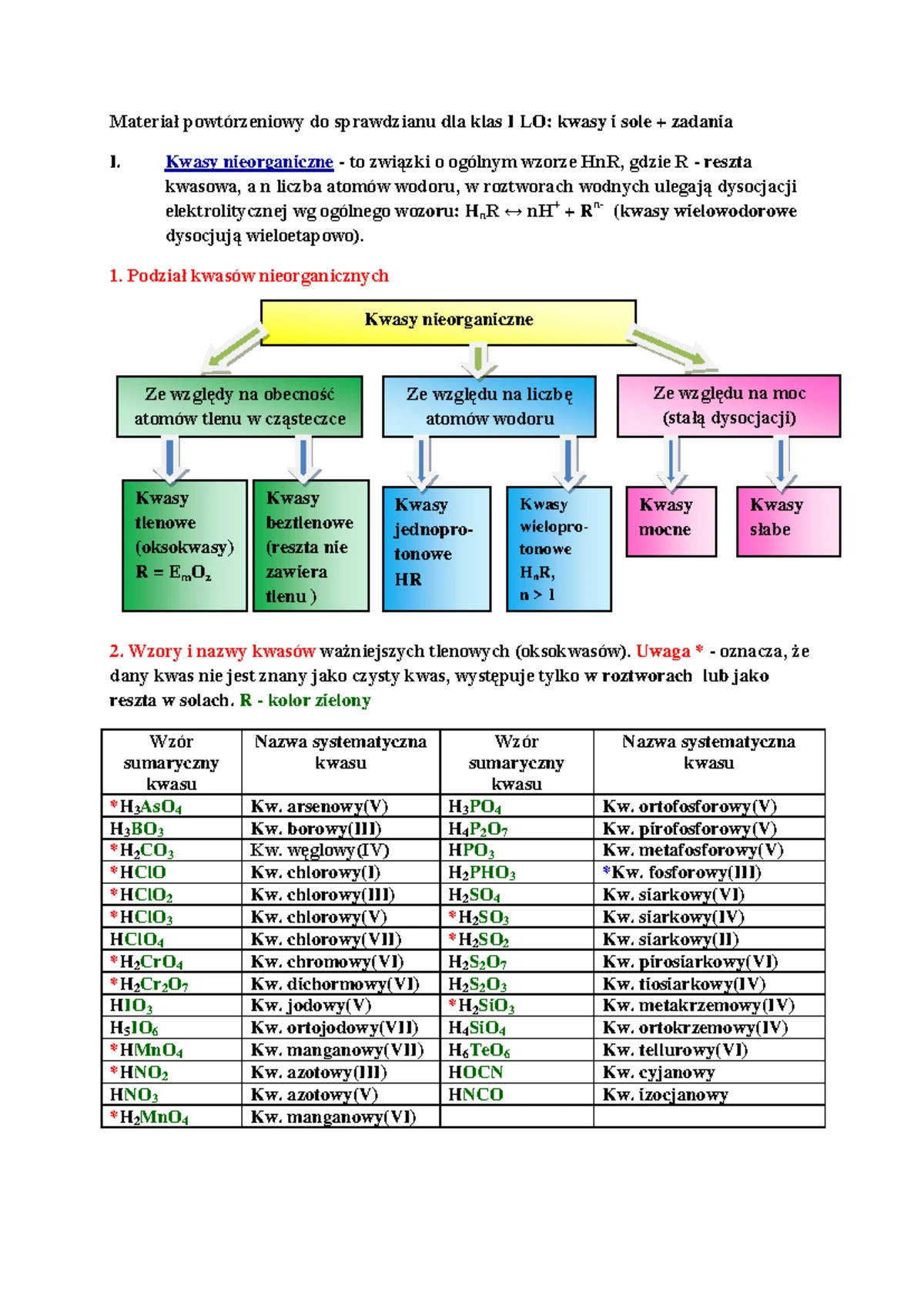
Chemia Sprawdzian Sole Gimnazjum Spra Fm

Rozumiemy doskonale, że dla wielu uczniów gimnazjum sprawdzian z chemii, a szczególnie dział poświęcony solom, może być źródłem niemałego stresu. Pamiętamy te momenty, gdy tabelka pierwiastków wydawała się nie do rozszyfrowania, a nazewnictwo związków chemicznych przyprawiało o ból głowy. To zupełnie naturalne! Chemia bywa postrzegana jako przedmiot abstrakcyjny, pełen wzorów i symboli, które na pierwszy rzut oka zdają się odległe od codziennego życia. Jednak prawda jest taka, że sole są wokół nas, kształtując nasze otoczenie i wpływając na nasze zdrowie w sposób, którego często nie doceniamy.
Sól – Znacznie Więcej Niż Tylko Sól Kuchenna
Kiedy mówimy "sole", natychmiast przychodzi na myśl chlorek sodu (NaCl) – ta biała substancja, którą dodajemy do potraw. Ale czy wiedzieliście, że to tylko jeden z tysięcy rodzajów soli? Sole to szeroka i fascynująca grupa związków chemicznych. Zbudowane są z kationów metali (lub jonu amonowego NH4+) oraz anionów reszt reszt kwasowych. Wyobraźcie sobie to jak puzzle: jeden element to "dodatnio naładowany metal" (kation), a drugi to "ujemnie naładowany fragment kwasu" (anion). Kiedy te puzzle się dopasują, powstaje sól!
Skąd biorą się Sole i Dlaczego Są Ważne?
Sole powstają głównie w wyniku reakcji chemicznych, takich jak:
- Reakcja kwasu z zasadą: Na przykład, reakcja kwasu solnego (HCl) z wodorotlenkiem sodu (NaOH) daje chlorek sodu (NaCl) i wodę (H2O). To tak, jakby mocny kwas i mocna zasada "neutralizowały" się nawzajem, tworząc coś łagodniejszego.
- Reakcja metalu z kwasem: Magnez (Mg) reaguje z kwasem siarkowym (H2SO4), tworząc siarczan magnezu (MgSO4) i wodór (H2). Metal "zjada" część kwasu, zostawiając sól i wydzielając gaz.
- Reakcja tlenku metalu z kwasem: Tlenek wapnia (CaO) reaguje z kwasem azotowym (HNO3), tworząc azotan wapnia (Ca(NO3)2) i wodę. Tlenek metalu "wchłania" kwas.
Wpływ soli na nasze życie jest ogromny. Już sam chlorek sodu jest niezbędny do funkcjonowania naszego organizmu. Reguluje gospodarkę wodną, jest kluczowy dla pracy układu nerwowego i mięśniowego. Ale to dopiero początek:
- Budownictwo: Wiele soli, jak cement (który jest złożoną mieszaniną różnych związków, w tym soli wapnia i glinu), jest fundamentem naszych budynków, dróg i mostów.
- Medycyna: Leki często bazują na solach. Na przykład, węglan wapnia jest składnikiem leków zobojętniających kwas żołądkowy, a cytryniany są używane w suplementach diety. Siarczan magnezu (tzw. sól Epsom) jest popularny w medycynie ludowej i kosmetyce.
- Rolnictwo: Nawozy sztuczne to w dużej mierze sole bogate w niezbędne pierwiastki, takie jak azot, fosfor i potas. Bez nich nasze uprawy nie byłyby tak wydajne. Azotany i fosforany to przykłady nawozów, które pomagają nam produkować żywność.
- Przemysł: Sole są wykorzystywane w produkcji szkła, mydła, papieru, barwników, a nawet w procesach oczyszczania wody. Chlorek potasu jest używany do produkcji nawozów i w przemyśle szklarskim.
Potencjalne Pułapki i Kontrowersje
Oczywiście, nie wszystkie sole są obojętne dla naszego zdrowia czy środowiska. Chociaż nauka często koncentruje się na pozytywnych aspektach i zastosowaniach, warto pamiętać o pewnych potencjalnych zagrożeniach. Przesadna ilość soli w diecie, zwłaszcza chlorku sodu, jest związana z problemami z nadciśnieniem i chorobami serca. Niektóre sole mogą być toksyczne w dużych stężeniach, a ich nadmierne uwalnianie do środowiska może prowadzić do zanieczyszczenia wód i gleby. Na przykład, sole metali ciężkich, takie jak kadm czy ołów, są bardzo szkodliwe.
Czasami pojawiają się również głosy krytyki dotyczące stosowania nawozów sztucznych. Argumentuje się, że mogą one prowadzić do eutrofizacji wód (nadmiernego wzrostu glonów spowodowanego nadmiarem substancji odżywczych) i negatywnie wpływać na bioróżnorodność gleby. Chociaż te obawy są uzasadnione, warto pamiętać, że nauka stale poszukuje bardziej zrównoważonych rozwiązań i metod aplikacji, aby zminimalizować negatywne skutki.
Jak Opanować Nazewnictwo i Wzory Soli?
Wiemy, że dla wielu uczniów największym wyzwaniem jest zapamiętanie nazw i poprawne tworzenie wzorów soli. To jak nauka nowego języka – wymaga praktyki i zrozumienia pewnych zasad. Pamiętajcie o dwóch kluczowych elementach:
- Kationy metali: To część pochodząca od pierwiastka metalicznego lub amonu (NH4+). Najczęściej spotykane to metale z grup 1 i 2 układu okresowego (np. Na+, K+, Ca2+, Mg2+) oraz metale przejściowe (np. Fe2+, Cu2+).
- Aniony reszt kwasowych: To pozostałość po kwasie, gdy odejmiemy od niego jony wodoru (H+). Na przykład, z kwasu solnego (HCl) powstaje anion chlorkowy (Cl-), a z kwasu siarkowego (H2SO4) powstaje anion siarczanowy (SO42-).
Klucz do sukcesu to znajomość stopni utlenienia. Każdy pierwiastek w związku chemicznym ma określony stopień utlenienia, który można odczytać z układu okresowego (dla grup 1 i 2 jest to zazwyczaj +1 i +2, dla tlenu -2, dla wodoru +1). W soli sumaryczny stopień utlenienia kationów i anionów musi być równy zero. To pozwala nam dobrać odpowiednią liczbę jonów, aby stworzyć neutralny związek.
Przykład: Chcemy utworzyć sól z kationu wapnia (Ca2+) i anionu chlorkowego (Cl-). Wiemy, że wapń ma stopień utlenienia +2, a chlor -1. Aby suma stopni utlenienia była równa zero, potrzebujemy jednego jonu wapnia (+2) i dwóch jonów chlorkowych (2 x -1 = -2). Dlatego wzór soli będzie wyglądał tak: CaCl2, czyli chlorek wapnia.
Inny przykład: Kation sodu (Na+, stopień utlenienia +1) i anion siarczanowy (SO42-, stopień utlenienia -2). Potrzebujemy dwóch jonów sodu (2 x +1 = +2) i jednego jonu siarczanowego (-2). Wzór to Na2SO4, czyli siarczan sodu.
Analogia: Wyobraźcie sobie, że budujecie wieżę z klocków. Klocki z jednej strony mają "haczyki" (kationy), a z drugiej "dziurki" (aniony). musicie dopasować tyle klocków, żeby wszystko do siebie pasowało i wieża była stabilna (ładunek wypadkowy wynosi zero). Jeśli macie mocny klocek z dwoma haczykami (Ca2+) i słabe klocki z jedną dziurką (Cl-), musicie wziąć dwa słabe klocki, żeby połączyć je z jednym mocnym.
Jak Skutecznie Przygotować się do Sprawdzianu?
Podejście do nauki może wydawać się przytłaczające, ale istnieją sprawdzone metody, które pomogą Wam odnieść sukces:
- Zacznijcie od podstaw: Upewnijcie się, że rozumiecie pojęcia takie jak jony, kationy, aniony, stopnie utlenienia i typowe reakcje tworzenia soli.
- Uczcie się nazw i wzorów w grupach: Grupowanie podobnych soli (np. wszystkie chlorki, wszystkie siarczany) może ułatwić zapamiętywanie.
- Twórzcie własne przykłady: Nie ograniczajcie się do podręcznika. Poćwiczcie tworzenie wzorów i nazw dla różnych kombinacji kationów i anionów.
- Wykorzystajcie karty pracy i ćwiczenia: Rozwiązywanie zadań to najlepszy sposób na utrwalenie wiedzy.
- Wizualizujcie: Spróbujcie narysować struktury cząsteczek lub wyobrazić sobie proces reakcji.
- Nie bójcie się pytać: Jeśli czegoś nie rozumiecie, zapytajcie nauczyciela lub kolegów. Wspólna nauka często przynosi najlepsze efekty.
- Powtarzajcie regularnie: Krótkie, ale częste sesje nauki są bardziej efektywne niż długie maratony tuż przed sprawdzianem.
Pamiętajcie, że sprawdzian z chemii to nie cel sam w sobie, ale narzędzie, które pomaga Wam zrozumieć otaczający świat. Sole, mimo swojej nazwy, są integralną częścią tego świata – od naszych posiłków, przez leki, po materiały budowlane. Zrozumienie ich budowy i właściwości otwiera drzwi do fascynujących zastosowań i pozwala lepiej docenić złożoność natury.
Czy udało Wam się dostrzec, jak obecne są sole w Waszym codziennym życiu? Jakie inne przykłady ich zastosowania przychodzą Wam na myśl?