Chemia 2 Wodorotlenki Sprawdzian Grupa C

Cześć! Dzisiaj zajmiemy się tematem wodorotlenków, który pojawił się w Waszym sprawdzianie Grupa C. Bez obaw, to całkiem prosty dział chemii, jeśli zrozumiemy podstawy. Zacznijmy od najważniejszego: definicji.
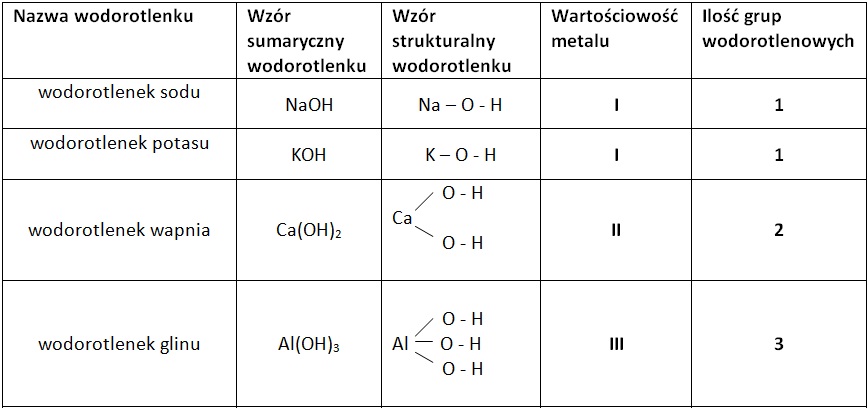
Co to są wodorotlenki? Wodorotlenki to związki chemiczne zbudowane z jonów metalu i jonów wodorotlenkowych (OH-). Wyobraźcie sobie, że to taka para: jeden metal (jak sód, potas czy magnez) i grupa OH. Ta grupa OH jest kluczowa – zawsze występuje w wodorotlenkach i nadaje im specyficzne właściwości.
Jak je rozpoznać? Najłatwiej poznać wodorotlenek po jego wzorze chemicznym. Zazwyczaj będzie on wyglądał tak: M(OH)n, gdzie M to symbol metalu, a "n" to liczba jonów wodorotlenkowych potrzebna do zbilansowania ładunku. Na przykład, wodorotlenek sodu ma wzór NaOH. Tutaj sód (Na) jest metalem, a obok niego jest jeden jon wodorotlenkowy (OH). Inny przykład to wodorotlenek wapnia: Ca(OH)2. Wapń (Ca) jest metalem, a ponieważ ma inny ładunek niż sód, potrzebuje dwóch jonów wodorotlenkowych, stąd dwójka w nawiasie.
Główne idee dotyczące wodorotlenków:
- Podstawa to metal i grupa OH: Pamiętajcie, że wodorotlenek to zawsze połączenie metalu z grupą wodorotlenkową.
- Właściwości zasadowe: Większość wodorotlenków (szczególnie te rozpuszczalne w wodzie) ma właściwości zasadowe. Oznacza to, że potrafią reagować z kwasami, tworząc sole i wodę. Są też w dotyku śliskie (jak np. mydło, które często jest mieszaniną soli sodowych lub potasowych kwasów tłuszczowych, a więc ma charakter zasadowy) i mogą powodować podrażnienia skóry.
- Rozpuszczalność w wodzie: Nie wszystkie wodorotlenki rozpuszczają się dobrze w wodzie. Wodorotlenki metali z grup 1 i 2 (z wyjątkiem magnezu, baru i strontu) są zazwyczaj dobrze rozpuszczalne i nazywamy je zasadami. Inne, jak wodorotlenek żelaza(III) – Fe(OH)3, są nierozpuszczalne lub słabo rozpuszczalne w wodzie.
- Powstawanie: Jak powstają wodorotlenki? Najczęściej przez reakcję metalu z wodą (np. 2Na + 2H2O → 2NaOH + H2↑) lub przez reakcję tlenku metalu z wodą (np. CaO + H2O → Ca(OH)2).
Praktyczne zastosowania wodorotlenków:
Wodorotlenki są obecne w naszym życiu codziennym w wielu miejscach:
- NaOH (wodorotlenek sodu): Nazywany też sodą kaustyczną. Używany jest do produkcji mydła, papieru, środków czystości, a także w przemyśle spożywczym.
- Ca(OH)2 (wodorotlenek wapnia): Znany jako wapno gaszone. Stosowany w budownictwie do tynków i zapraw, w rolnictwie do odkwaszania gleby, a także w przemyśle cukrowniczym.
- Mg(OH)2 (wodorotlenek magnezu): Jest składnikiem wielu leków zobojętniających kwas żołądkowy, czyli stosuje się go w leczeniu zgagi.
Mam nadzieję, że teraz temat wodorotlenków jest dla Was jaśniejszy! Powodzenia na kolejnych sprawdzianach!