1 Zasada Termodznamiki Zamkor Sprawdzian
Czy zdarzyło Ci się kiedyś stać przed egzaminem, czując przytłoczenie ogromem materiału? Wiedza z termodynamiki, a zwłaszcza pierwsza zasada, bywa dla wielu studentów prawdziwym wyzwaniem. Pamiętam mój pierwszy rok studiów – te wszystkie wzory, definicje, i pytanie: "Jak to wszystko ogarnąć, żeby zrozumieć, a nie tylko zapamiętać?". Pierwsza zasada termodynamiki, choć brzmi skomplikowanie, jest tak naprawdę kluczem do zrozumienia wielu zjawisk zachodzących wokół nas. W tym artykule chcę podzielić się z Tobą sprawdzonymi sposobami na jej przyswojenie, tak abyś nie tylko zdał sprawdzian, ale przede wszystkim naprawdę ją poczuł.
Pierwsza Zasada Termodynamiki: Co To Właściwie Jest?
Zacznijmy od podstaw. W najprostszych słowach, pierwsza zasada termodynamiki to nic innego jak zasada zachowania energii zastosowana do układów termodynamicznych. Wyobraź sobie ciepło jako pewną formę energii, która może przepływać, być zamieniana na pracę, albo zwiększać wewnętrzną energię systemu. Nigdy jednak nie ginie ani nie powstaje z niczego.
Professor Willard Gibbs, jeden z pionierów termodynamiki, mawiał: "Termodynamika to szczególna nauka, która nigdy nie zostanie obalona". I coś w tym jest. Ta zasada jest fundamentalna dla fizyki, chemii, inżynierii, a nawet biologii. Zrozumienie jej pozwala nam analizować i przewidywać zachowanie systemów – od prostego silnika parowego po skomplikowane procesy metaboliczne w naszym organizmie.
Matematyczna Formalizacja: Wzór, Który Warto Znać
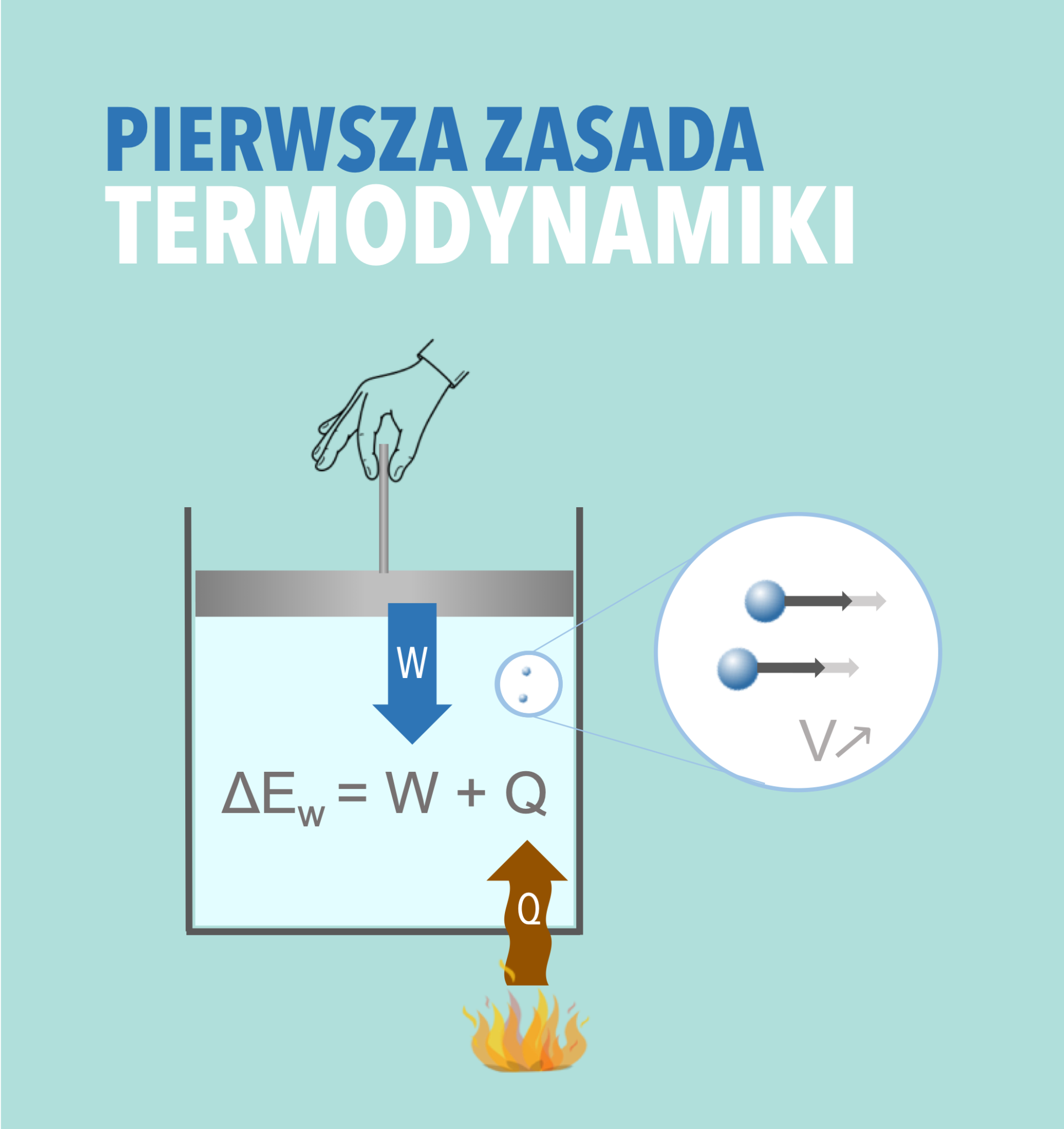
Formalnie pierwsza zasada termodynamiki wyrażana jest równaniem:
ΔU = Q - W
Gdzie:
- ΔU to zmiana energii wewnętrznej układu. Energia wewnętrzna to suma wszystkich energii kinetycznych i potencjalnych cząsteczek tworzących układ. Myśl o tym jak o całkowitej energii "w środku" systemu.
- Q to ciepło dostarczone do układu. Jeśli ciepło jest odbierane, Q jest ujemne.
- W to praca wykonana przez układ. Jeśli praca jest wykonywana nad układem, W jest ujemne.
To równanie mówi nam, że jeśli dodamy ciepło do systemu (Q > 0), to ta energia może albo zwiększyć jego energię wewnętrzną (ΔU > 0), albo zostać zamieniona na pracę wykonaną przez system (W > 0), albo jedno i drugie. Jeśli system wykonuje pracę (W > 0), to musi skądś tę energię wziąć – albo z dostarczonego ciepła, albo zmniejszając swoją energię wewnętrzną.
Warto tutaj wspomnieć o konwencji znaków. Czasami spotkacie się z zapisem ΔU = Q + W, gdzie W oznacza pracę wykonaną *nad* układem. Ważne jest, aby być konsekwentnym w stosowaniu przyjętej konwencji, aby uniknąć błędów.
Kluczowe Pojęcia do Zrozumienia
Aby w pełni pojąć pierwszą zasadę, musimy dobrze zrozumieć kilka kluczowych pojęć:
Energia Wewnętrzna (U)
Jak już wspomnieliśmy, energia wewnętrzna to suma energii cząsteczek. Dla gazu doskonałego, gdzie siły międzycząsteczkowe są pomijalne, energia wewnętrzna zależy wyłącznie od temperatury. Im wyższa temperatura, tym większa energia kinetyczna cząsteczek, a tym samym większa energia wewnętrzna. W praktyce, zmiana energii wewnętrznej jest ściśle związana ze zmianą temperatury układu.
Ciepło (Q)
Ciepło to energia przekazywana między układami z powodu różnicy temperatur. Jest to proces nieuporządkowany, chaotyczny. Pamiętaj, że układ nie posiada ciepła; może je jedynie wymieniać. Wyobraź sobie gorącą filiżankę kawy – ciepło przepływa od kawy do otoczenia, aż do momentu wyrównania temperatur.
Ważne są tu pojęcia:
- Ciepło właściwe (c): Ilość ciepła potrzebna do podniesienia temperatury jednostki masy substancji o jeden stopień Celsjusza (lub Kelwina).
- Pojemność cieplna (C): Ilość ciepła potrzebna do podniesienia temperatury całego ciała o jeden stopień. C = m * c, gdzie m to masa.
Zatem ilość ciepła potrzebna do zmiany temperatury można obliczyć ze wzoru: Q = m * c * ΔT lub Q = C * ΔT.
Praca (W)
Praca w termodynamice zazwyczaj odnosi się do pracy objętościowej, czyli pracy związanej ze zmianą objętości układu, na przykład rozprężającego się gazu. Gdy gaz się rozpręża, wykonuje pracę nad otoczeniem, popychając tłok lub rozszerzając balon. Gdy gaz jest sprężany, otoczenie wykonuje pracę nad gazem.
Dla procesu izobarycznego (stałe ciśnienie), praca jest obliczana jako:
W = p * ΔV
Gdzie:
- p to ciśnienie zewnętrzne.
- ΔV to zmiana objętości układu.
Jeśli objętość rośnie (ΔV > 0), gaz wykonuje pracę (W > 0). Jeśli objętość maleje (ΔV < 0), praca jest wykonywana nad gazem (W < 0).
Rodzaje Procesów Termodynamicznych a Pierwsza Zasada
Zrozumienie, jak pierwsza zasada zachowuje się w różnych rodzajach procesów, jest kluczem do rozwiązywania zadań.
Proces Izotermiczny (Stała Temperatura)
W procesie izotermicznym temperatura się nie zmienia, co oznacza, że zmiana energii wewnętrznej jest zerowa (ΔU = 0). Dlaczego? Bo dla gazu doskonałego energia wewnętrzna zależy tylko od temperatury. W takim przypadku, pierwsza zasada upraszcza się do:
0 = Q - W, czyli Q = W
Oznacza to, że całe ciepło dostarczone do układu jest zamieniane na pracę wykonaną przez układ, lub odwrotnie, cała praca wykonana nad układem jest oddawana jako ciepło. Przykłady to powolne rozprężanie lub sprężanie gazu w kontakcie z termostatem.
Proces Izobaryczny (Stałe Ciśnienie)
W tym procesie ciśnienie pozostaje stałe, ale objętość i temperatura mogą się zmieniać. Stosujemy tu wzór ΔU = Q - pΔV. Jeśli gaz się rozpręża, wykonuje pracę, a jeśli jest podgrzewany, jego energia wewnętrzna rośnie, co często przekłada się na wzrost temperatury i objętości.
Proces Izchoryczny (Stała Objętość)
Jeśli objętość układu się nie zmienia (ΔV = 0), to praca wykonana przez układ jest zerowa (W = 0). Pierwsza zasada przyjmuje wtedy postać:
ΔU = Q
Wszystko ciepło dostarczone do układu idzie na zwiększenie jego energii wewnętrznej, a co za tym idzie, na podniesienie temperatury. Przykładem jest podgrzewanie gazu w szczelnie zamkniętym, sztywnym zbiorniku.
Proces Adiabatyczny (Bez Wymiany Ciepła)
W procesie adiabatycznym nie ma wymiany ciepła z otoczeniem (Q = 0). Dlatego pierwsza zasada upraszcza się do:
ΔU = -W
Oznacza to, że jeśli układ wykonuje pracę (W > 0), musi ona być "skonsumowana" z jego energii wewnętrznej (ΔU < 0), co prowadzi do obniżenia temperatury. Jeśli nad układem wykonuje się pracę (W < 0), energia wewnętrzna rośnie (ΔU > 0), a temperatura wzrasta. Szybkie sprężanie powietrza w pompie rowerowej, które powoduje jej nagrzewanie, jest dobrym przykładem procesu zbliżonego do adiabatycznego.
Jak Się Przygotować do Sprawdzianu? Praktyczne Wskazówki
Wiem, że nauka do sprawdzianu może być stresująca. Oto kilka strategii, które pomogły wielu moim studentom:
1. Zrozumienie, Nie Wkuwanie
Zamiast zapamiętywać wzory na pamięć, spróbuj zobaczyć fizyczny sens każdego symbolu i każdej zasady. Pomyśl o przykładach z życia codziennego. Dlaczego gorąca kawa stygnie? Dlaczego balon po napompowaniu jest ciepły? Te intuicyjne obrazy pomagają utrwalić abstrakcyjne pojęcia.
2. Wizualizacja Procesów
Diagramy P-V (ciśnienie-objętość) są Twoimi najlepszymi przyjaciółmi. Rysuj je! Zaznaczaj na nich punkty początkowe i końcowe procesów, a także ścieżki. Pole pod krzywą na wykresie P-V reprezentuje pracę wykonaną. To wizualne przedstawienie pomaga zrozumieć, jak ciepło i praca wpływają na energię wewnętrzną.
Pewne badania, jak te publikowane w "Journal of Chemical Education", pokazują, że studenci, którzy angażują się w wizualne i analogiczne metody uczenia się termodynamiki, osiągają lepsze wyniki i mają głębsze zrozumienie materiału.
3. Rozwiązywanie Zadań – Krok po Kroku
To najważniejsza część. Zacznij od najprostszych zadań i stopniowo zwiększaj trudność. Przy każdym zadaniu zadawaj sobie pytania:
- Jaki to rodzaj procesu (izotermiczny, izochoryczny, adiabatyczny, izobaryczny)?
- Które zmienne są stałe, a które się zmieniają?
- Jaka jest wartość Q, W, ΔU?
- Jakie są jednostki?
Nie bój się popełniać błędów. Błędy to najlepsze lekcje. Analizuj je, staraj się zrozumieć, dlaczego wystąpiły.
4. Korzystanie z Materiałów Dodatkowych
Oprócz podręcznika, poszukaj filmów instruktażowych na YouTube, interaktywnych symulacji online, a nawet grupowych sesji nauki. Dyskusja z innymi studentami często pozwala spojrzeć na problem z innej perspekury.
Professor Richard Feynman, laureat Nagrody Nobla, często podkreślał znaczenie "myślenia o tym, jak myślisz". Analizując swoje błędy w rozwiązywaniu zadań, uczysz się lepiej rozumieć proces nauki.
5. Kluczowe Punkty do Zapamiętania Przed Sprawdzianem
- Zachowanie energii: Energia nigdy nie znika, tylko zmienia formę.
- ΔU = Q - W: Zrozumienie znaczenia każdego symbolu.
- Konwencje znaków: Bądź konsekwentny.
- Różne procesy: Jak pierwsza zasada upraszcza się dla procesów izotermicznych, izobarycznych, izochorycznych i adiabatycznych.
- Wykresy P-V: Potrafią wyjaśnić więcej niż tysiąc słów.
Podsumowanie
Pierwsza zasada termodynamiki to nie tylko wzór, ale fundamentalne prawo natury. Zrozumienie jej otwiera drzwi do pojmowania świata na głębszym poziomie. Mam nadzieję, że ten artykuł, skupiając się na empatii, jasności i praktycznych wskazówkach, pomoże Ci pokonać wszelkie trudności i poczuć się pewniej przed sprawdzianem. Pamiętaj, że nauka to proces, a cierpliwość i determinacja są kluczami do sukcesu. Powodzenia!






