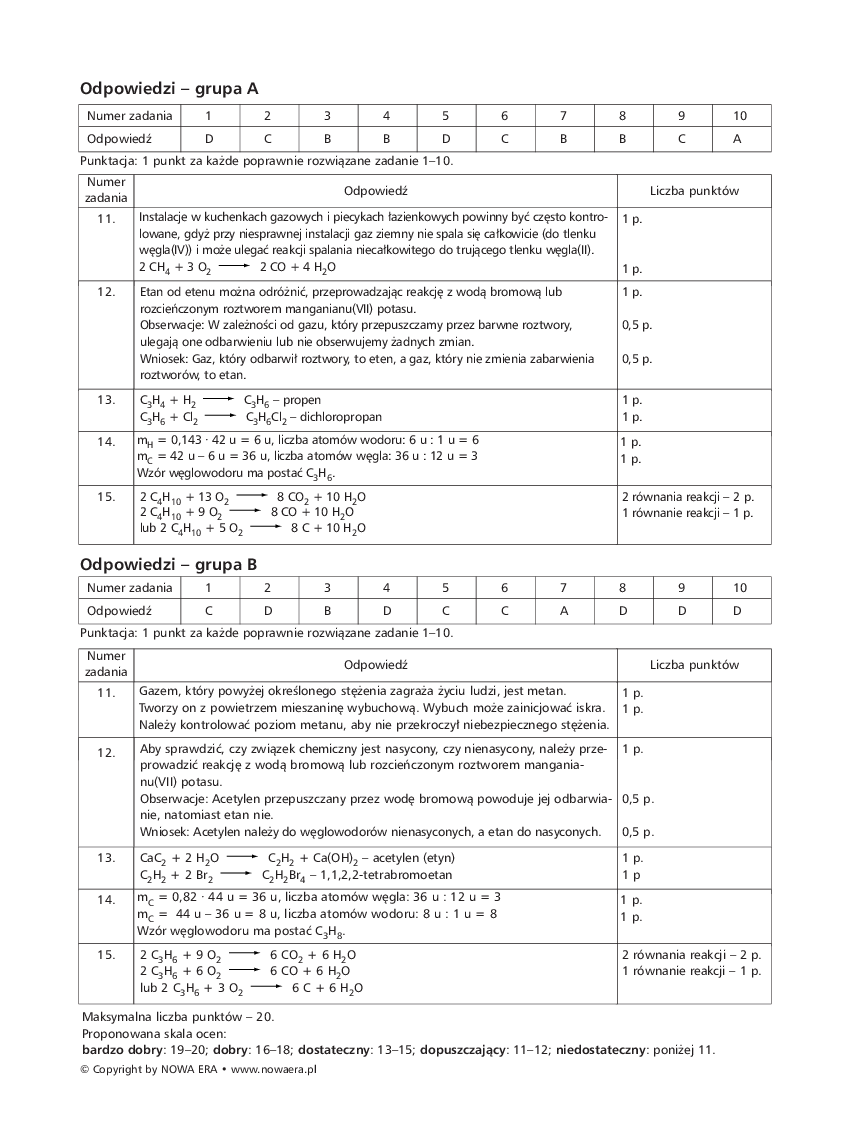
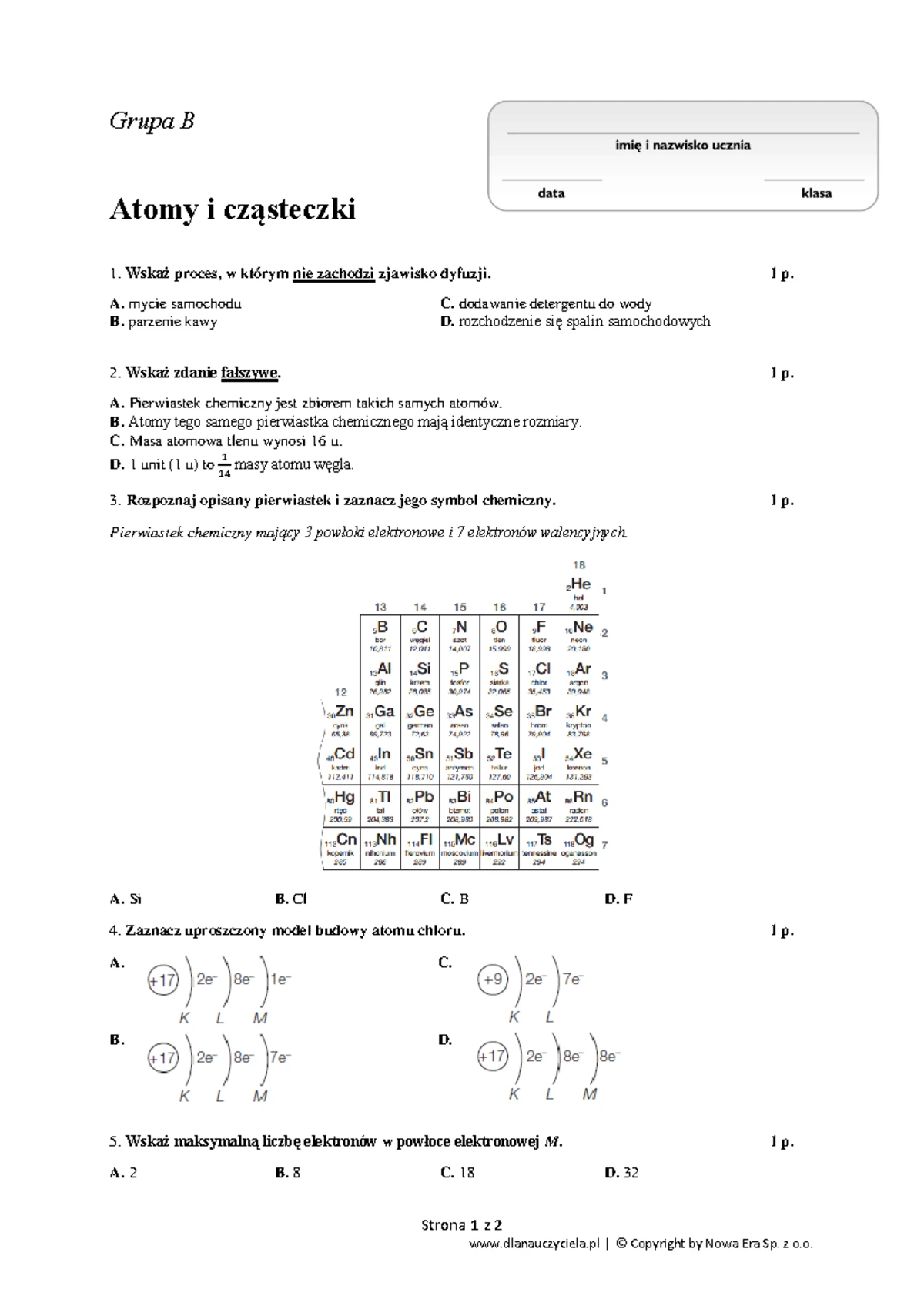
Związki Węgla Z Wodorem Sprawdzian Klasa 8

Czy zastanawiałeś się kiedyś, co łączy gaz w kuchence, plastikową butelkę i Twoje ubranie? Odpowiedź jest prosta: węgiel i wodór. Związki tych dwóch pierwiastków, zwane węglowodorami, są wszechobecne w naszym życiu. Ten artykuł został stworzony specjalnie dla uczniów klasy 8, którzy przygotowują się do sprawdzianu z chemii. Razem zgłębimy tajemnice węglowodorów, zrozumiemy ich budowę, podział i właściwości, a także dowiemy się, jak je rozpoznać. Przygotuj się na fascynującą podróż po świecie chemii organicznej!
Co to są węglowodory?
Węglowodory to związki organiczne zbudowane wyłącznie z atomów węgla (C) i wodoru (H). Ich nazwa wywodzi się właśnie od tych dwóch pierwiastków. Są to podstawowe składniki ropy naftowej i gazu ziemnego, które stanowią główne źródło energii dla współczesnego świata. Zrozumienie węglowodorów jest kluczowe do zrozumienia wielu procesów chemicznych i zjawisk zachodzących wokół nas.
Dlaczego węgiel i wodór tak chętnie się łączą? Węgiel posiada cztery elektrony walencyjne, co oznacza, że może tworzyć aż cztery wiązania kowalencyjne. Wodór posiada jeden elektron walencyjny i może tworzyć jedno wiązanie. Ta zdolność węgla do tworzenia wielu wiązań pozwala na powstawanie długich łańcuchów i różnorodnych struktur, co prowadzi do ogromnej liczby różnych węglowodorów.
Podział węglowodorów
Węglowodory dzielimy na kilka głównych grup, w zależności od budowy ich łańcucha węglowego i rodzaju wiązań między atomami węgla.
Węglowodory alifatyczne
To węglowodory o łańcuchu prostym lub rozgałęzionym. Dzielą się na:
- Alkany: Zawierają wyłącznie wiązania pojedyncze między atomami węgla. Ich wzór ogólny to CnH2n+2. Przykładem jest metan (CH4), etan (C2H6) i propan (C3H8). Alkany są stosunkowo niereaktywne.
- Alkeny: Zawierają jedno wiązanie podwójne między atomami węgla. Ich wzór ogólny to CnH2n. Przykładem jest eten (C2H4), zwany etylenem, który jest wykorzystywany do produkcji plastiku. Alkeny są bardziej reaktywne niż alkany.
- Alkiny: Zawierają jedno wiązanie potrójne między atomami węgla. Ich wzór ogólny to CnH2n-2. Przykładem jest etyn (C2H2), zwany acetylenem, który jest używany w palnikach spawalniczych. Alkiny są najbardziej reaktywne spośród węglowodorów alifatycznych.
Węglowodory cykliczne
To węglowodory, w których atomy węgla tworzą zamknięty pierścień. Dzielą się na:
- Cyklany: Zawierają wyłącznie wiązania pojedyncze w pierścieniu. Przykładem jest cyklopropan i cyklobutan.
- Cyklany nienasycone: Zawierają wiązania podwójne w pierścieniu.
Węglowodory aromatyczne
Charakteryzują się obecnością pierścienia benzenowego (C6H6), który jest bardzo stabilną strukturą. Przykładem jest benzen i toluen. Węglowodory aromatyczne mają charakterystyczny zapach i są wykorzystywane w przemyśle chemicznym.
Właściwości węglowodorów
Właściwości węglowodorów zależą od ich struktury, długości łańcucha węglowego i obecności wiązania wielokrotnych.
- Stan skupienia: Krótkie łańcuchy węglowe (np. metan, etan) są gazami w temperaturze pokojowej. Dłuższe łańcuchy (np. heksan, oktan) są cieczami, a bardzo długie łańcuchy (np. parafina) są ciałami stałymi.
- Temperatura wrzenia: Temperatura wrzenia rośnie wraz z długością łańcucha węglowego.
- Rozpuszczalność: Węglowodory są nierozpuszczalne w wodzie (są hydrofobowe) i dobrze rozpuszczają się w rozpuszczalnikach organicznych.
- Reaktywność: Alkany są stosunkowo niereaktywne. Alkeny i alkiny, ze względu na obecność wiązań wielokrotnych, są bardziej reaktywne i ulegają reakcjom addycji, polimeryzacji i spalania.
- Palność: Wszystkie węglowodory są palne. Spalanie węglowodorów to reakcja z tlenem, w wyniku której powstaje dwutlenek węgla (CO2) i woda (H2O), a także wydziela się energia w postaci ciepła i światła.
Reakcje węglowodorów
Zrozumienie reakcji węglowodorów jest kluczowe do zdania sprawdzianu. Oto kilka najważniejszych reakcji:
- Spalanie całkowite: Węgiel reaguje z tlenem, tworząc dwutlenek węgla i wodę (CO2 + H2O). Jest to efektywny sposób na pozyskiwanie energii.
Przykład: CH4 + 2O2 → CO2 + 2H2O
- Spalanie niecałkowite: Węgiel reaguje z ograniczoną ilością tlenu, tworząc tlenek węgla (czad) i wodę (CO + H2O) lub sam węgiel (C + H2O). Jest to proces niebezpieczny, ponieważ tlenek węgla jest trujący.
Przykład: 2CH4 + 3O2 → 2CO + 4H2O
- Addycja: Reakcja charakterystyczna dla alkenów i alkinów, polegająca na przyłączeniu atomów lub grup atomów do wiązania wielokrotnego, powodując jego rozerwanie i powstanie wiązań pojedynczych.
- Substytucja: Reakcja charakterystyczna dla alkanów i węglowodorów aromatycznych, polegająca na zastąpieniu atomu wodoru innym atomem lub grupą atomów.
Jak rozpoznać węglowodory?
Na sprawdzianie mogą pojawić się pytania dotyczące rozpoznawania węglowodorów. Oto kilka wskazówek:
- Obecność węgla i wodoru: Jeśli związek zawiera tylko węgiel i wodór, to na pewno jest węglowodorem.
- Rodzaj wiązań: Sprawdź, czy w cząsteczce występują wiązania pojedyncze, podwójne lub potrójne. To pomoże Ci określić, czy masz do czynienia z alkanem, alkenem czy alkinem.
- Struktura: Zwróć uwagę na kształt łańcucha węglowego. Czy jest prosty, rozgałęziony, czy tworzy pierścień?
- Wzór ogólny: Pamiętaj o wzorach ogólnych dla poszczególnych grup węglowodorów (CnH2n+2 dla alkanów, CnH2n dla alkenów, CnH2n-2 dla alkinów).
- Reakcje charakterystyczne: Wiedza o reakcjach charakterystycznych dla poszczególnych grup węglowodorów (np. addycja dla alkenów i alkinów) pomoże Ci je odróżnić.
Węglowodory w życiu codziennym
Węglowodory otaczają nas z każdej strony. Są obecne w:
- Paliwach: Benzyna, olej napędowy i gaz ziemny to mieszaniny węglowodorów, które wykorzystujemy do napędzania samochodów, ogrzewania domów i produkcji energii elektrycznej.
- Plastikach: Polietylen, polipropylen i polichlorek winylu (PVC) to polimery, które powstają z węglowodorów i są wykorzystywane do produkcji opakowań, mebli, rur i wielu innych przedmiotów.
- Kosmetykach: Wiele kosmetyków zawiera węglowodory, które pełnią funkcję rozpuszczalników, emulgatorów i substancji zapachowych.
- Lekach: Wiele leków zawiera w swojej strukturze węglowodory.
Podsumowanie i ćwiczenia
Gratulacje! Dotarłeś do końca tego artykułu. Teraz powinieneś mieć solidne podstawy wiedzy o węglowodorach. Pamiętaj, że kluczem do sukcesu na sprawdzianie jest systematyczna nauka i rozwiązywanie zadań. Spróbuj odpowiedzieć na poniższe pytania, aby utrwalić zdobytą wiedzę:
- Co to są węglowodory?
- Jakie są główne grupy węglowodorów?
- Czym różnią się alkany, alkeny i alkiny?
- Jakie są właściwości węglowodorów?
- Jakie reakcje zachodzą z udziałem węglowodorów?
- Gdzie w życiu codziennym spotykamy węglowodory?
Powodzenia na sprawdzianie! Pamiętaj, że chemia może być fascynująca, jeśli podejdziemy do niej z ciekawością i zaangażowaniem. Nie bój się zadawać pytań i szukać odpowiedzi. Życzymy Ci samych sukcesów w nauce!