Wodorotlenki Sprawdzian 2 Gimnazjum Odpowiedzi

Wodorotlenki, jako jedna z podstawowych grup związków nieorganicznych, stanowią kluczowy element programu nauczania chemii w gimnazjum. Zrozumienie ich właściwości, budowy i reakcji jest fundamentalne nie tylko dla dalszej edukacji w zakresie nauk ścisłych, ale także dla pojmowania otaczającego nas świata. Test sprawdzający wiedzę z tego zakresu, często określany jako "Wodorotlenki Sprawdzian 2 Gimnazjum Odpowiedzi", jest momentem, w którym uczniowie mogą zweryfikować swoje opanowanie materiału. Skupmy się zatem na tym, co oznaczają te sprawdziany i jakie aspekty wiedzy o wodorotlenkach są w nich zazwyczaj poruszane.
Co to są Wodorotlenki i dlaczego są ważne?
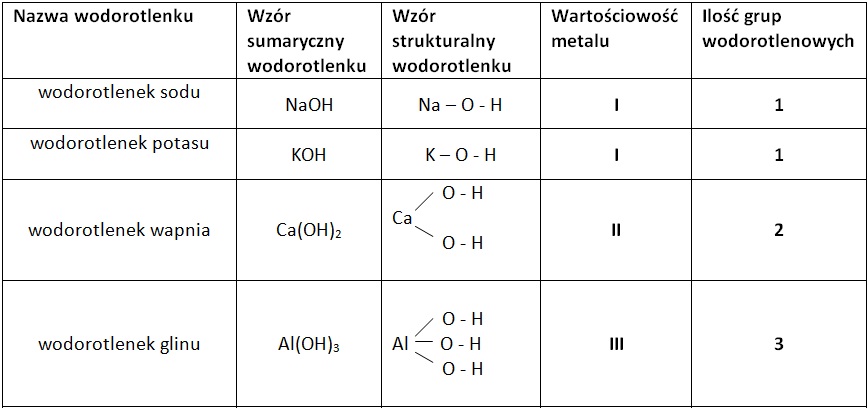
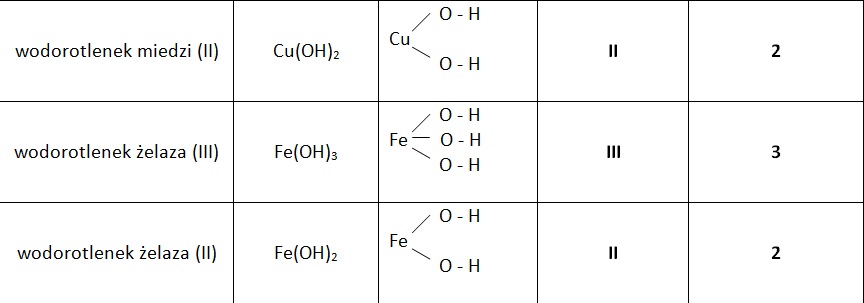
Wodorotlenki to związki chemiczne, które powstają w reakcji metali z grupami wodorotlenowymi (-OH). Wzór ogólny wodorotlenków to M(OH)n, gdzie M oznacza symbol metalu, a n jego wartościowość. Najprostszym i najbardziej znanym wodorotlenkiem jest woda (H2O), choć klasyfikuje się ją czasem jako specyficzny przypadek. Typowe wodorotlenki, nazywane również zasadami lub wodorotlenkami metali, są substancjami o zróżnicowanych właściwościach fizycznych i chemicznych. W szkole podstawowej i gimnazjum szczególny nacisk kładzie się na wodorotlenki metali alkalicznych (grupa 1) i metali ziem alkalicznych (grupa 2), które są silnie zasadowe, oraz na wodorotlenki metali przejściowych, często o charakterze amfoterycznym lub słabo zasadowym.
Znaczenie wodorotlenków wykracza daleko poza podręcznik chemiczny. Są one obecne w wielu procesach przemysłowych i naturalnych. Na przykład, wodorotlenek sodu (NaOH), zwany sodą kaustyczną, jest powszechnie stosowany w produkcji papieru, mydła, detergentów, a także w procesach oczyszczania ścieków. Wodorotlenek wapnia (Ca(OH)2), czyli wapno gaszone, jest kluczowy w budownictwie (zaprawy, tynki) oraz w rolnictwie jako środek odkwaszający glebę. Wodorotlenek magnezu (Mg(OH)2) jest wykorzystywany w medycynie jako środek zobojętniający nadmiar kwasu w żołądku. Ta wszechobecność sprawia, że zrozumienie podstawowych praw rządzących wodorotlenkami jest kluczowe dla obywatela XXI wieku.
Analiza sprawdzianu "Wodorotlenki Sprawdzian 2 Gimnazjum Odpowiedzi"
Sprawdzian z wodorotlenków dla drugiego etapu gimnazjum zazwyczaj obejmuje kilka kluczowych obszarów wiedzy. Rozważmy je szczegółowo:
1. Budowa i Nomenklatura Wodorotlenków
Uczniowie powinni być w stanie zidentyfikować grupę wodorotlenową (-OH) i określić wartość grupy hydroksylowej (zazwyczaj -I). Kolejnym ważnym aspektem jest umiejętność ustalania wzoru sumarycznego wodorotlenku na podstawie podanej nazwy i odwrotnie. Wymaga to znajomości symboli metali i ich typowych wartościowości. Typowe zadania obejmują:
- Ustalenie wzoru dla wodorotlenku potasu (KOH), wodorotlenku magnezu (Mg(OH)2), wodorotlenku glinu (Al(OH)3).
- Podanie nazw dla związków o wzorach: NaOH, Ca(OH)2, Fe(OH)3.
Ważne jest, aby pamiętać o poprawnej pisowni nazwy, często przez dodanie przedrostka określającego liczbę grup OH, jeśli metal ma zmienną wartościowość lub gdy jest to konieczne dla jednoznaczności.
2. Właściwości Fizyczne Wodorotlenków
W tej części sprawdzianu często pojawiają się pytania dotyczące stanu skupienia, barwy, rozpuszczalności w wodzie oraz odczuć smakowych (choć testy zwykle tego unikają ze względów bezpieczeństwa). Warto podkreślić, że:
- Wodorotlenki metali grup 1 i 2 (tzw. zasady) są zazwyczaj dobrze rozpuszczalne w wodzie, tworząc roztwory alkaliczne.
- Wodorotlenki metali przejściowych są często słabo rozpuszczalne lub nierozpuszczalne w wodzie.
- Wiele wodorotlenków jest higroskopijnych, co oznacza, że chłoną wilgoć z powietrza.
Znajomość tych właściwości jest istotna dla zrozumienia reaktywności chemicznej.
3. Właściwości Chemiczne Wodorotlenków
To jest serce większości sprawdzianów. Uczniowie powinni opanować:
- Reakcje z kwasami: Wodorotlenki reagują z kwasami w reakcji zobojętniania, tworząc sól i wodę. Jest to fundamentalna reakcja, którą często przedstawia się w postaci ogólnej: zasada + kwas → sól + woda. Przykładem jest reakcja NaOH z HCl: NaOH + HCl → NaCl + H2O.
- Reakcje z tlenkami niemetali: Rozpuszczalne wodorotlenki (zasady) reagują z kwasowymi tlenkami niemetali, tworząc sól i wodę. Przykład: 2NaOH + CO2 → Na2CO3 + H2O.
- Dekompozycja termiczna: Wiele wodorotlenków, zwłaszcza metali przejściowych, ulega rozkładowi pod wpływem podwyższonej temperatury, tworząc odpowiedni tlenek metalu i wodę. Przykład: Cu(OH)2 → CuO + H2O.
- Amfoteryczność: Niektóre wodorotlenki, takie jak wodorotlenek glinu (Al(OH)3) i wodorotlenek cynku (Zn(OH)2), wykazują właściwości amfoteryczne, czyli mogą reagować zarówno z kwasami, jak i z silnymi zasadami.
Eksperci podkreślają, że umiejętność pisania i bilansowania równań reakcji jest kluczowa. Jak mówi profesor Janusz Sawicki, autorytet w dziedzinie dydaktyki chemii: "Nie ma nauki chemii bez równań. Równanie reakcji to język, którym opisujemy przemiany materii. Uczeń, który nie potrafi go napisać, tak naprawdę nie rozumie procesu."
4. Zastosowania Praktyczne Wodorotlenków
Sprawdziany często testują wiedzę o praktycznym zastosowaniu omawianych związków. Warto zapamiętać kilka kluczowych przykładów, które mogą pojawić się w pytaniach:
- Soda kaustyczna (NaOH): Produkcja mydła, papieru, tekstyliów, odkażanie, usuwanie zanieczyszczeń przemysłowych.
- Soda oczyszczona (NaHCO3): Substancja spulchniająca w pieczeniu, środek zobojętniający kwasowość. (Choć jest to wodorowęglan, często powiązana z wodorotlenkami).
- Wapno gaszone (Ca(OH)2): Budownictwo, bielenie ścian, regulacja pH gleby, uzdatnianie wody.
- Wodorotlenek magnezu (Mg(OH)2): Leki zobojętniające kwas żołądkowy, antiperspiranty.
Rozumienie tych zastosowań pomaga uczniom dostrzec relewantność nauki chemii w codziennym życiu.
Podsumowanie
Sprawdziany z wodorotlenków dla drugiego etapu gimnazjum mają na celu weryfikację opanowania podstawowych koncepcji związanych z tą grupą związków. Kluczowe są: prawidłowa nomenklatura, znajomość właściwości fizycznych i chemicznych, a przede wszystkim umiejętność pisania i interpretacji równań reakcji. Właściwe przygotowanie do takiego sprawdzianu, obejmujące powtórzenie definicji, wzorów, reakcji i zastosowań, znacząco zwiększa szanse na sukces. Pamiętajmy, że nauka chemii to proces, a każdy sprawdzian jest okazją do identyfikacji obszarów wymagających dalszego doskonalenia.