Woda I Roztwory 7 Klasa Sprawdzian
W klasie 7 nauka o wodzie i roztworach stanowi fundamentalny krok w zrozumieniu chemii. Ten sprawdzian sprawdza, jak dobrze uczniowie opanowali podstawowe pojęcia związane z wodą jako rozpuszczalnikiem, rodzajami roztworów, rozpuszczalnością i metodami rozdzielania mieszanin. Przyjrzyjmy się bliżej kluczowym elementom tego zagadnienia.
Woda – niezwykły rozpuszczalnik
Właściwości wody i budowa cząsteczki
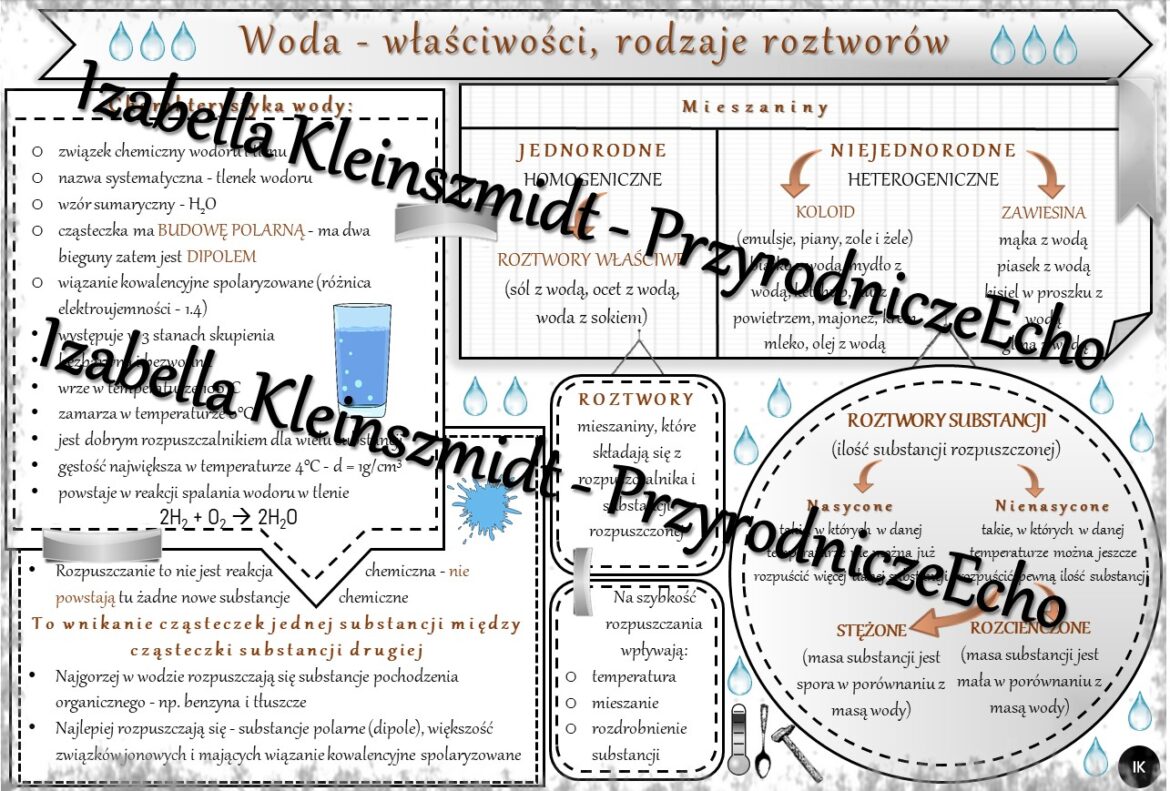
Woda (H2O) to związek chemiczny o wyjątkowych właściwościach. Jest to spowodowane jej polarną budową. Cząsteczka wody składa się z atomu tlenu i dwóch atomów wodoru, które są połączone wiązaniami kowalencyjnymi spolaryzowanymi. Atom tlenu jest bardziej elektroujemny niż atom wodoru, co oznacza, że przyciąga elektrony z większą siłą. Powoduje to, że na atomie tlenu pojawia się cząstkowy ładunek ujemny (δ-), a na atomach wodoru cząstkowy ładunek dodatni (δ+).
Ta polarność umożliwia tworzenie wiązań wodorowych między cząsteczkami wody. Wiązania wodorowe są słabsze niż wiązania kowalencyjne, ale wciąż mają istotny wpływ na właściwości wody, takie jak wysokie napięcie powierzchniowe, wysoka ciepłota właściwa i anomalna rozszerzalność termiczna.
Anomalna rozszerzalność termiczna oznacza, że woda osiąga największą gęstość w temperaturze 4°C. Poniżej tej temperatury, gęstość wody maleje, co powoduje, że lód jest lżejszy od wody i pływa na jej powierzchni. To zjawisko jest kluczowe dla życia w zbiornikach wodnych, ponieważ zapobiega zamarzaniu ich od dna.
Rozpuszczanie substancji w wodzie
Woda jest doskonałym rozpuszczalnikiem dla wielu substancji, zwłaszcza związków jonowych i polarnych. Proces rozpuszczania polega na otaczaniu cząsteczek substancji rozpuszczanej przez cząsteczki wody (hydratacja). W przypadku związków jonowych, takich jak chlorek sodu (NaCl), jony sodu (Na+) i chlorkowe (Cl-) są oddzielane od siebie i otaczane przez cząsteczki wody, stabilizując jony w roztworze.
Zasada "podobne rozpuszcza się w podobnym" oznacza, że substancje polarne dobrze rozpuszczają się w rozpuszczalnikach polarnych (np. woda), a substancje niepolarne dobrze rozpuszczają się w rozpuszczalnikach niepolarnych (np. benzyna).
Rodzaje roztworów
Roztwory nienasycone, nasycone i przesycone
Roztwór nienasycony to roztwór, w którym można jeszcze rozpuścić dodatkową ilość substancji rozpuszczanej w danej temperaturze.
Roztwór nasycony to roztwór, w którym w danej temperaturze rozpuszczono maksymalną możliwą ilość substancji rozpuszczanej. Dalsze dodawanie substancji rozpuszczanej spowoduje, że substancja ta pozostanie nierozpuszczona na dnie naczynia.
Roztwór przesycony to roztwór, w którym rozpuszczono więcej substancji rozpuszczanej niż wynosi jej rozpuszczalność w danej temperaturze. Takie roztwory są nietrwałe i łatwo ulegają krystalizacji, czyli wytrącaniu się nadmiaru substancji rozpuszczanej w postaci kryształów. Roztwory przesycone można otrzymać przez powolne ochładzanie nasyconego roztworu, w którym nie ma zarodków krystalizacji.
Stężenie roztworu
Stężenie roztworu określa ilość substancji rozpuszczonej w danej ilości roztworu lub rozpuszczalnika. Najczęściej używane jednostki stężenia to:
- Stężenie procentowe (Cp): wyraża masę substancji rozpuszczonej w 100 gramach roztworu. Wzór na stężenie procentowe: Cp = (ms / mr) * 100%, gdzie ms to masa substancji rozpuszczonej, a mr to masa roztworu.
- Stężenie molowe (Cm): wyraża liczbę moli substancji rozpuszczonej w 1 litrze roztworu. Wzór na stężenie molowe: Cm = n / V, gdzie n to liczba moli substancji rozpuszczonej, a V to objętość roztworu w litrach.
Przeliczanie stężeń jest częstym zadaniem na sprawdzianach. Wymaga zrozumienia definicji stężeń i umiejętności korzystania z odpowiednich wzorów.
Rozpuszczalność
Czynniki wpływające na rozpuszczalność
Rozpuszczalność to maksymalna ilość substancji, którą można rozpuścić w danej ilości rozpuszczalnika w określonej temperaturze. Na rozpuszczalność wpływają następujące czynniki:
- Rodzaj substancji rozpuszczanej i rozpuszczalnika: Jak wspomniano wcześniej, "podobne rozpuszcza się w podobnym".
- Temperatura: Dla większości substancji stałych rozpuszczalność rośnie wraz ze wzrostem temperatury. Dla gazów rozpuszczalność maleje wraz ze wzrostem temperatury.
- Ciśnienie: Ciśnienie ma istotny wpływ na rozpuszczalność gazów. Zgodnie z prawem Henry'ego, rozpuszczalność gazu w cieczy jest wprost proporcjonalna do ciśnienia parcjalnego tego gazu nad cieczą.
Krzywe rozpuszczalności
Krzywe rozpuszczalności to wykresy przedstawiające zależność rozpuszczalności danej substancji od temperatury. Umożliwiają odczytanie maksymalnej ilości substancji, którą można rozpuścić w danej temperaturze. Analiza krzywych rozpuszczalności jest ważna przy planowaniu procesów krystalizacji i rekrystalizacji.
Metody rozdzielania mieszanin
Dekantacja
Dekantacja to metoda oddzielania cieczy od osadu. Polega na ostrożnym zlewaniu cieczy znad osadu, starając się nie zmącić osadu. Jest to prosta i szybka metoda, ale nie zapewnia całkowitego oddzielenia składników.
Sączenie (filtracja)
Sączenie (filtracja) to metoda oddzielania ciał stałych od cieczy lub gazów za pomocą materiału porowatego, zwanego filtrem. Filtr zatrzymuje cząstki stałe, a przepuszcza ciecz lub gaz. Przykłady filtrów to bibuła filtracyjna, tkanina, piasek.
Destylacja
Destylacja to metoda rozdzielania mieszanin ciekłych na podstawie różnic w temperaturach wrzenia składników. Mieszanina jest podgrzewana, a składnik o niższej temperaturze wrzenia paruje pierwszy. Pary są następnie skraplane i zbierane jako oddzielny składnik. Destylacja jest powszechnie stosowana w przemyśle chemicznym i petrochemicznym.
Odparowywanie
Odparowywanie to metoda oddzielania substancji stałej rozpuszczonej w cieczy. Polega na ogrzewaniu roztworu, co powoduje odparowanie cieczy i pozostawienie substancji stałej jako osadu. Jest to prosta metoda, ale nie pozwala na odzyskanie cieczy.
Chromatografia
Chromatografia to zaawansowana metoda rozdzielania mieszanin, opierająca się na różnicach w powinowactwie składników mieszaniny do dwóch faz: fazy stacjonarnej i fazy ruchomej. Składniki mieszaniny są rozdzielane na skutek różnic w ich szybkości przemieszczania się przez fazę stacjonarną pod wpływem fazy ruchomej. Istnieją różne rodzaje chromatografii, takie jak chromatografia cienkowarstwowa (TLC), chromatografia gazowa (GC) i chromatografia cieczowa (HPLC).
Przykłady zastosowań
Wiedza o wodzie i roztworach ma ogromne znaczenie w wielu dziedzinach życia:
- Życie codzienne: Przygotowywanie napojów, gotowanie potraw, pranie ubrań, oczyszczanie wody.
- Przemysł spożywczy: Produkcja napojów, konserw, słodyczy.
- Medycyna: Przygotowywanie leków, roztworów infuzyjnych, diagnozowanie chorób na podstawie analizy krwi i moczu.
- Rolnictwo: Nawożenie roślin, nawadnianie, ochrona roślin przed szkodnikami.
- Ochrona środowiska: Oczyszczanie ścieków, monitorowanie jakości wody.
Przykład z życia codziennego: Przygotowanie roztworu soli fizjologicznej (0,9% NaCl) do przemywania ran. Trzeba dokładnie odważyć 0,9 grama soli i rozpuścić ją w 100 gramach wody. Nieprawidłowe stężenie może podrażnić ranę.
Przykład z przemysłu: Destylacja ropy naftowej w rafineriach. Ropa naftowa jest mieszaniną węglowodorów o różnych temperaturach wrzenia. Destylacja pozwala na rozdzielenie ropy naftowej na frakcje takie jak benzyna, olej napędowy, nafta i mazut.
Podsumowanie i wezwanie do działania
Nauka o wodzie i roztworach to fundamentalna wiedza, która jest niezbędna do zrozumienia wielu procesów zachodzących w przyrodzie i w technologii. Sprawdzian z tego zakresu wymaga solidnego opanowania teorii i umiejętności rozwiązywania zadań obliczeniowych. Kluczem do sukcesu jest zrozumienie definicji podstawowych pojęć, znajomość wzorów i umiejętność ich stosowania, a także umiejętność analizy krzywych rozpuszczalności i schematów procesów rozdzielania mieszanin. Pamiętaj, solidne przygotowanie i zrozumienie tematu to gwarancja sukcesu na sprawdzianie!
Aby dobrze przygotować się do sprawdzianu, zachęcam do:
- Powtórzenia notatek z lekcji.
- Przeczytania podręcznika.
- Rozwiązania zadań z zeszytu ćwiczeń.
- Wykonania dodatkowych zadań z Internetu.
- Zadawania pytań nauczycielowi, jeśli masz jakieś wątpliwości.
- Pracy w grupach z innymi uczniami.
Powodzenia na sprawdzianie! Wierzę w Ciebie!






