Wodorotlenki to związki chemiczne o fundamentalnym znaczeniu w chemii i wielu gałęziach przemysłu. Charakteryzują się szeregiem unikalnych właściwości, które determinują ich zastosowanie. Zrozumienie tych właściwości jest kluczowe do efektywnego wykorzystania wodorotlenków w różnych procesach. Niniejszy artykuł ma na celu przedstawienie i omówienie najważniejszych właściwości wodorotlenków, ich wpływu na reakcje chemiczne oraz praktyczne zastosowania.
Właściwości Fizyczne Wodorotlenków
Stan skupienia i wygląd
Wodorotlenki metali alkalicznych (np. wodorotlenek sodu NaOH, wodorotlenek potasu KOH) są zazwyczaj ciałami stałymi o krystalicznej strukturze. Często występują w postaci białych, higroskopijnych granulek lub płatków. Z kolei wodorotlenki metali ziem alkalicznych (np. wodorotlenek wapnia Ca(OH)2) również są ciałami stałymi, jednak charakteryzują się mniejszą rozpuszczalnością w wodzie. Wodorotlenki metali przejściowych (np. wodorotlenek żelaza(III) Fe(OH)3) są zwykle nierozpuszczalne w wodzie i tworzą osady o charakterystycznych barwach.
Rozpuszczalność w wodzie
Rozpuszczalność w wodzie jest jedną z najważniejszych właściwości wodorotlenków. Wodorotlenki metali alkalicznych są bardzo dobrze rozpuszczalne w wodzie, tworząc silnie zasadowe roztwory. Wodorotlenki metali ziem alkalicznych rozpuszczają się w wodzie w mniejszym stopniu, a ich rozpuszczalność zależy od temperatury. Wodorotlenki metali przejściowych generalnie charakteryzują się niską rozpuszczalnością, co powoduje tworzenie osadów w roztworach wodnych. Przykładowo, rozpuszczalność NaOH w wodzie wynosi około 111 g na 100 ml wody w temperaturze 20°C, podczas gdy rozpuszczalność Ca(OH)2 jest znacznie niższa i wynosi około 0.17 g na 100 ml wody w tej samej temperaturze.
Właściwości higroskopijne
Wiele wodorotlenków, zwłaszcza te metali alkalicznych, wykazuje silne właściwości higroskopijne, czyli zdolność do pochłaniania wilgoci z otoczenia. Dlatego też, wodorotlenek sodu (NaOH) przechowywany na powietrzu, szybko absorbuje wodę i dwutlenek węgla z atmosfery, ulegając tzw. rozpływaniu się. Ta właściwość ma istotne znaczenie w procesach suszenia i jako środek osuszający w laboratoriach i przemyśle.
Właściwości Chemiczne Wodorotlenków
Charakter zasadowy
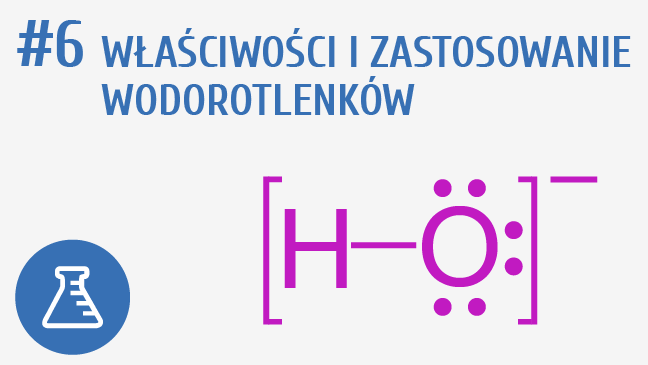
Podstawową właściwością chemiczną wodorotlenków jest ich charakter zasadowy. W roztworach wodnych dysocjują na kationy metalu i aniony wodorotlenkowe (OH-). Aniony wodorotlenkowe powodują, że roztwory wodorotlenków mają pH powyżej 7. Siła zasady zależy od zdolności do dysocjacji i uwalniania jonów OH-. Wodorotlenki metali alkalicznych są jednymi z najsilniejszych zasad.
Reakcje zobojętniania
Wodorotlenki reagują z kwasami w reakcji zobojętniania, tworząc sól i wodę. Reakcja ta jest egzotermiczna, co oznacza, że wydziela się ciepło. Przykładowo, reakcja wodorotlenku sodu (NaOH) z kwasem solnym (HCl) prowadzi do powstania chlorku sodu (NaCl) i wody (H2O): NaOH + HCl → NaCl + H2O. Reakcje zobojętniania są fundamentalne w analizie chemicznej (miareczkowanie) i w neutralizacji odpadów przemysłowych.
Reakcje z tlenkami niemetali
Wodorotlenki reagują z tlenkami niemetali, tworząc sole. Na przykład, wodorotlenek sodu reaguje z dwutlenkiem węgla, tworząc węglan sodu: 2NaOH + CO2 → Na2CO3 + H2O. Ta reakcja jest wykorzystywana do usuwania CO2 z powietrza, np. w systemach podtrzymywania życia w statkach kosmicznych i łodziach podwodnych.
Reakcje z solami
Wodorotlenki mogą reagować z solami, prowadząc do powstania nowych wodorotlenków i soli, pod warunkiem że jeden z produktów reakcji jest nierozpuszczalny (wytrąca się osad). Przykładem jest reakcja wodorotlenku sodu z chlorkiem żelaza(III): 3NaOH + FeCl3 → Fe(OH)3 (osad) + 3NaCl. Powstający osad wodorotlenku żelaza(III) ma charakterystyczny rdzawy kolor.
Wpływ na metale
Wodorotlenki, zwłaszcza te silnie zasadowe, mogą reagować z niektórymi metalami amfoterycznymi, takimi jak cynk (Zn) i glin (Al), prowadząc do powstawania związków kompleksowych (soli kompleksowych) i wydzielania wodoru. Przykładowo, reakcja glinu z wodorotlenkiem sodu przebiega według równania: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑. Wydzielający się wodór jest palny, dlatego należy zachować ostrożność podczas przeprowadzania takich reakcji.
Przykłady Zastosowań Wodorotlenków
Przemysł chemiczny
Wodorotlenki są szeroko stosowane w przemyśle chemicznym jako reagenty w syntezie organicznej i nieorganicznej. Wodorotlenek sodu (NaOH) jest używany w produkcji mydeł, detergentów, papieru, sztucznego jedwabiu, aluminium i wielu innych produktów. Wodorotlenek potasu (KOH) znajduje zastosowanie w produkcji mydeł potasowych (mydła w płynie), nawozów oraz jako elektrolit w akumulatorach alkalicznych.
Oczyszczanie ścieków
Wodorotlenek wapnia (Ca(OH)2), zwany również wapnem gaszonym, jest stosowany do neutralizacji kwasów w ściekach przemysłowych oraz do zmiękczania wody. Dodatkowo, wodorotlenki metali, takie jak wodorotlenek żelaza(III) (Fe(OH)3), mogą być używane do usuwania zanieczyszczeń z wody poprzez koagulację.
Przemysł spożywczy
Wodorotlenki, w ograniczonym zakresie i przy zachowaniu odpowiednich środków ostrożności, znajdują zastosowanie w przemyśle spożywczym. Wodorotlenek sodu (NaOH) jest używany do obierania warzyw i owoców (np. ziemniaków, brzoskwiń), a także do regulacji pH w niektórych produktach spożywczych. Należy jednak pamiętać, że wodorotlenki są substancjami żrącymi i muszą być używane zgodnie z odpowiednimi przepisami i normami.
Budownictwo
Wodorotlenek wapnia (Ca(OH)2) jest kluczowym składnikiem zaprawy murarskiej i tynkarskiej. Reaguje z dwutlenkiem węgla z powietrza, tworząc węglan wapnia (CaCO3), który twardnieje, spajając materiały budowlane. Wapno budowlane dodaje się również do gleby w celu podniesienia jej pH (wapnowanie).
Podsumowanie
Wodorotlenki charakteryzują się szeregiem unikalnych właściwości fizycznych i chemicznych, które determinują ich szerokie zastosowanie w różnych dziedzinach nauki i przemysłu. Od silnych właściwości zasadowych i reakcji zobojętniania po zastosowania w oczyszczaniu ścieków, przemyśle chemicznym, spożywczym i budownictwie, wodorotlenki odgrywają kluczową rolę. Zrozumienie ich właściwości jest niezbędne do bezpiecznego i efektywnego wykorzystania tych związków chemicznych.
Zachęcamy do dalszego zgłębiania wiedzy na temat wodorotlenków i ich zastosowań, aby w pełni wykorzystać potencjał tych niezwykle ważnych związków chemicznych. Pamiętajmy o bezpiecznym obchodzeniu się z wodorotlenkami, stosując odpowiednie środki ostrożności i przestrzegając zaleceń producentów.