Hej! Przygotowujesz się do sprawdzianu z wiązań chemicznych w klasie 7? Super! Razem damy radę to ogarnąć. Pamiętaj, chemia może być fajna!
Na początek, przypomnijmy sobie, czym w ogóle są te wiązania. Wiązanie chemiczne to po prostu siła, która utrzymuje atomy razem, tworząc cząsteczki lub sieci krystaliczne. Dzięki nim istnieje cały świat wokół nas!
Najważniejsze typy wiązań, które musisz znać, to wiązanie kowalencyjne, wiązanie jonowe i, w mniejszym stopniu, wiązanie metaliczne. Skupmy się na tych dwóch pierwszych, bo to one zwykle sprawiają najwięcej problemów.
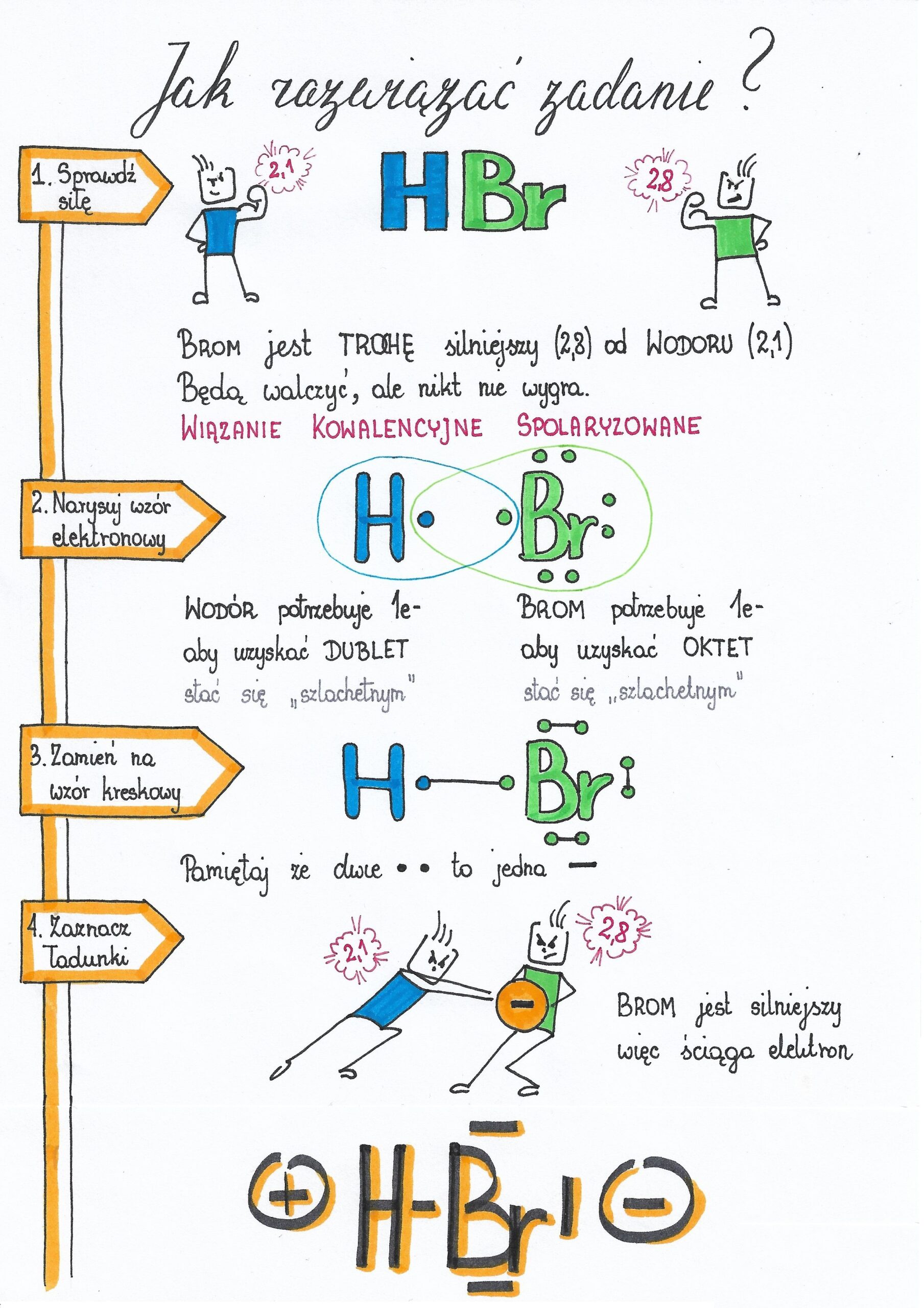
Wiązanie kowalencyjne powstaje, gdy atomy wspólnie używają elektronów. Wyobraź sobie, że dzielą się zabawkami. Dzieje się tak zazwyczaj między atomami niemetali. Pamiętaj, że istnieją wiązania kowalencyjne niespolaryzowane (równe dzielenie elektronów) i spolaryzowane (nierówne dzielenie). Polarność zależy od elektroujemności atomów.
Jeśli jeden atom jest o wiele bardziej elektroujemny niż drugi, powstaje wiązanie jonowe. Wtedy atom bardziej elektroujemny "kradnie" elektron atomowi mniej elektroujemnemu. Powstają jony: kation (jon dodatni) i anion (jon ujemny). Przyciąganie elektrostatyczne między nimi to właśnie wiązanie jonowe. Typowe dla połączeń metali z niemetalami.
Zapamiętaj: elektroujemność to miara zdolności atomu do przyciągania elektronów w wiązaniu. Im większa różnica elektroujemności między atomami, tym bardziej polarne wiązanie, aż do powstania wiązania jonowego.
Jak odróżnić wiązanie kowalencyjne od jonowego? Spójrz na tabelę układu okresowego. Metale reagują z niemetalami, tworząc związki jonowe. Niemetale reagują między sobą, tworząc związki kowalencyjne.
Na sprawdzianie mogą pojawić się pytania o właściwości związków jonowych i kowalencyjnych. Związki jonowe mają zazwyczaj wysoką temperaturę topnienia i wrzenia, dobrze rozpuszczają się w wodzie i przewodzą prąd elektryczny w roztworze lub stanie stopionym. Związki kowalencyjne często mają niższe temperatury topnienia i wrzenia, a ich rozpuszczalność i przewodnictwo zależą od polarności.
Poćwicz rysowanie wzorów Lewisa (elektronowych) dla prostych cząsteczek. To pomoże Ci zrozumieć, jak elektrony są rozmieszczone w wiązaniu i jak powstają wiązania kowalencyjne.
Nie stresuj się! Przejrzyj notatki, rozwiąż kilka zadań i przypomnij sobie podstawowe definicje. Dasz radę!
Podsumowanie najważniejszych punktów:
- Wiązanie chemiczne to siła utrzymująca atomy razem.
- Wiązanie kowalencyjne: dzielenie się elektronami (niemetale).
- Wiązanie jonowe: przekazywanie elektronów (metal i niemetal).
- Elektroujemność: miara zdolności atomu do przyciągania elektronów.
- Znajomość właściwości związków jonowych i kowalencyjnych.
Powodzenia na sprawdzianie! Wierzę w Ciebie!