Sprawdzian Z Chemii Budowa Materii

Chemia, nauka o materii i jej właściwościach, zaczyna się od fundamentów: budowy materii. Zrozumienie tego obszaru jest kluczowe do pojęcia, jak substancje oddziałują ze sobą, jakie reakcje zachodzą i jak możemy wykorzystać te procesy w różnych dziedzinach. Sprawdzian z tego działu chemii wymaga solidnej wiedzy teoretycznej oraz umiejętności zastosowania jej w praktycznych zadaniach.
Podstawowe Pojęcia: Atomy i Pierwiastki
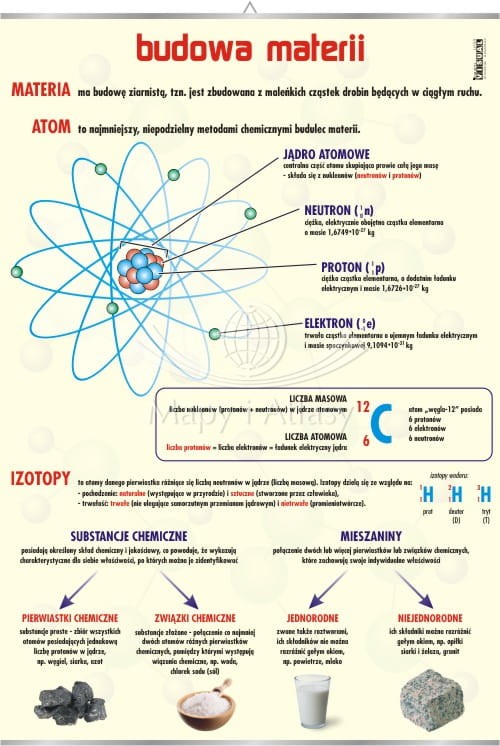
Atom – Elementarna Cegiełka Materii
Atom to najmniejsza, niepodzielna (chemicznie) jednostka pierwiastka, zachowująca jego właściwości. Składa się z jądra atomowego, zawierającego protony (ładunek dodatni) i neutrony (ładunek neutralny), oraz z elektronów (ładunek ujemny) krążących wokół jądra. Liczba protonów w jądrze określa liczbę atomową (Z) pierwiastka, która jednoznacznie identyfikuje dany pierwiastek.
Przykładowo, atom węgla (C) ma liczbę atomową Z = 6, co oznacza, że w jego jądrze znajduje się 6 protonów. Liczba neutronów może być różna, co prowadzi do powstania izotopów – atomów tego samego pierwiastka o różnej liczbie neutronów.
Masa atomowa (A) to suma liczby protonów i neutronów w jądrze atomowym. Masa atomowa jest wyrażana w jednostkach masy atomowej (u).
Pierwiastki i Układ Okresowy
Pierwiastek to substancja, która składa się tylko z atomów o tej samej liczbie atomowej. Pierwiastki są uszeregowane w układzie okresowym, zgodnie z rosnącą liczbą atomową. Układ okresowy odzwierciedla regularne zmiany właściwości pierwiastków, wynikające z ich konfiguracji elektronowej.
Grupy (kolumny) w układzie okresowym zawierają pierwiastki o podobnych właściwościach chemicznych, ponieważ mają one podobną liczbę elektronów walencyjnych (elektrony na ostatniej powłoce). Na przykład, metale alkaliczne (grupa 1) charakteryzują się wysoką reaktywnością chemiczną, wynikającą z łatwości oddawania jednego elektronu walencyjnego.
Okresy (rzędy) w układzie okresowym reprezentują atomy, których elektrony walencyjne obsadzają kolejne powłoki elektronowe.
Wiązania Chemiczne: Łącząc Atomy
Wiązanie Jonowe
Wiązanie jonowe powstaje w wyniku elektrostatycznego przyciągania między jonami o przeciwnych ładunkach. Jony powstają, gdy atom oddaje lub przyjmuje elektrony, aby uzyskać stabilną konfigurację elektronową (zwykle oktet elektronowy na ostatniej powłoce). Wiązanie jonowe występuje najczęściej między metalami i niemetalami.
Przykładem jest chlorek sodu (NaCl), sól kuchenna. Atom sodu (Na) oddaje jeden elektron atomowi chloru (Cl), tworząc kation sodu (Na+) i anion chlorkowy (Cl-). Elektrostatyczne przyciąganie między tymi jonami prowadzi do powstania stabilnej struktury krystalicznej.
Związki jonowe charakteryzują się wysokimi temperaturami topnienia i wrzenia, są kruchymi substancjami i dobrze rozpuszczają się w wodzie, tworząc roztwory przewodzące prąd elektryczny.
Wiązanie Kowalencyjne
Wiązanie kowalencyjne powstaje w wyniku uwspólniania elektronów między dwoma atomami. Wiązanie kowalencyjne występuje najczęściej między niemetalami. Wyróżniamy wiązania kowalencyjne niespolaryzowane (elektrony są równomiernie rozłożone między atomami, np. w cząsteczce wodoru, H2) i spolaryzowane (elektrony są przesunięte w kierunku atomu bardziej elektroujemnego, np. w cząsteczce wody, H2O).
Wiązanie kowalencyjne spolaryzowane powoduje powstanie cząsteczek polarnych, które mają biegun dodatni i ujemny. Polarność cząsteczek ma istotny wpływ na ich właściwości fizyczne, takie jak temperatura wrzenia i rozpuszczalność.
Przykłady związków kowalencyjnych to woda (H2O), metan (CH4) i dwutlenek węgla (CO2). Związki kowalencyjne mogą mieć różne stany skupienia (gaz, ciecz, ciało stałe) i różne temperatury topnienia i wrzenia, w zależności od siły wiązań międzycząsteczkowych.
Wiązanie Metaliczne
Wiązanie metaliczne występuje w metalach i polega na oddziaływaniu elektrostatycznym między kationami metali i "morzem" elektronów walencyjnych, które są delokalizowane (nie są związane z konkretnym atomem). Delokalizacja elektronów umożliwia metalom przewodzenie prądu elektrycznego i ciepła oraz nadaje im charakterystyczny metaliczny połysk.
Metale charakteryzują się wysokimi temperaturami topnienia i wrzenia, są kowalne (można je formować w blachy) i ciągliwe (można je ciągnąć w druty).
Oddziaływania Międzycząsteczkowe
Oprócz wiązań chemicznych, istnieją również oddziaływania międzycząsteczkowe, które wpływają na właściwości fizyczne substancji. Do najważniejszych oddziaływań międzycząsteczkowych należą:
- Siły Van der Waalsa: słabe oddziaływania między cząsteczkami, wynikające z chwilowych fluktuacji gęstości elektronowej.
- Oddziaływania dipol-dipol: oddziaływania między cząsteczkami polarnymi.
- Wiązania wodorowe: silne oddziaływania dipol-dipol między atomem wodoru związanym z atomem elektroujemnym (np. tlenem, azotem, fluorem) a innym atomem elektroujemnym.
Wiązania wodorowe mają szczególne znaczenie dla właściwości wody. Powodują one, że woda ma stosunkowo wysoką temperaturę wrzenia, dużą pojemność cieplną i jest dobrym rozpuszczalnikiem dla wielu substancji.
Struktura Krystaliczna i Amorficzna
Substancje krystaliczne mają uporządkowaną strukturę, w której atomy, jony lub cząsteczki są ułożone w regularny wzór, tworząc sieć krystaliczną. Substancje krystaliczne mają ostre temperatury topnienia.
Przykłady substancji krystalicznych to sól kuchenna (NaCl), diament (C) i kwarc (SiO2).
Substancje amorficzne nie mają uporządkowanej struktury. Atomy, jony lub cząsteczki są ułożone w sposób przypadkowy. Substancje amorficzne miękną w szerokim zakresie temperatur, zamiast topnieć w ostrej temperaturze.
Przykładem substancji amorficznej jest szkło.
Przemiany Fazowe
Przemiany fazowe to procesy, w których substancja zmienia swój stan skupienia (stały, ciekły, gazowy). Przemiany fazowe zachodzą w określonych temperaturach i ciśnieniach, z wymianą energii cieplnej.
Najważniejsze przemiany fazowe to:
- Topnienie: przejście ze stanu stałego w stan ciekły.
- Krzepnięcie: przejście ze stanu ciekłego w stan stały.
- Parowanie: przejście ze stanu ciekłego w stan gazowy.
- Skraplanie: przejście ze stanu gazowego w stan ciekły.
- Sublimacja: przejście ze stanu stałego w stan gazowy.
- Resublimacja: przejście ze stanu gazowego w stan stały.
Temperatura, w której zachodzi dana przemiana fazowa, zależy od rodzaju substancji i ciśnienia. Na przykład, temperatura topnienia lodu wynosi 0°C pod ciśnieniem atmosferycznym.
Przykłady Zastosowań i Dane Rzeczywiste
Zrozumienie budowy materii ma kluczowe znaczenie w wielu dziedzinach nauki i technologii. Na przykład:
- W medycynie, znajomość budowy i właściwości leków pozwala na projektowanie nowych, skuteczniejszych terapii.
- W inżynierii materiałowej, wiedza o strukturze materiałów pozwala na opracowywanie nowych materiałów o pożądanych właściwościach, takich jak wytrzymałość, lekkość i odporność na korozję.
- W energetyce, badania nad materiałami o wysokiej przewodności elektrycznej i cieplnej prowadzą do opracowywania wydajniejszych ogniw słonecznych i baterii.
Dane rzeczywiste pokazują, że opracowanie nowych materiałów, takich jak grafen (jednowarstwowa struktura węgla o wyjątkowych właściwościach) i perowskity (materiały o strukturze krystalicznej, które mogą być wykorzystywane w ogniwach słonecznych), ma ogromny potencjał w rozwoju nowoczesnych technologii.
Podsumowanie i Wskazówki
Przygotowując się do sprawdzianu z budowy materii, należy skupić się na zrozumieniu podstawowych pojęć, takich jak atomy, pierwiastki, wiązania chemiczne i oddziaływania międzycząsteczkowe. Ważne jest również, aby umieć zastosować tę wiedzę w praktycznych zadaniach, takich jak przewidywanie właściwości substancji na podstawie ich struktury. Utrwalaj wiedzę rozwiązując zadania obliczeniowe i opisowe. Staraj się zrozumieć mechanizmy zachodzące na poziomie atomowym i molekularnym, co pozwoli Ci lepiej pojąć zjawiska makroskopowe. Pamiętaj o praktycznym zastosowaniu tej wiedzy – to klucz do sukcesu! Powodzenia na sprawdzianie!