Otrzymywanie Wodorotlenku
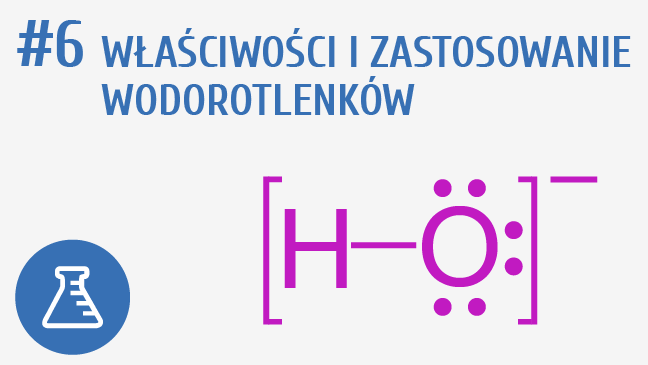
Otrzymywanie wodorotlenku to proces tworzenia związku chemicznego zwanego wodorotlenkiem. Mówiąc najprościej, polega on na wprowadzeniu grupy hydroksylowej (OH-) do związku chemicznego, najczęściej metalu.
Proces ten można zrealizować na kilka sposobów, z których najpopularniejsze to:
- Reakcja metalu z wodą: Nie wszystkie metale reagują z wodą, ale te, które reagują, tworzą wodorotlenek metalu i wodór. Stopień reakcji zależy od aktywności metalu. Metale alkaliczne (np. sód, potas) reagują bardzo gwałtownie, a metale ziem alkalicznych (np. wapń) reagują mniej intensywnie.
- Reakcja tlenku metalu z wodą: Tlenki metali zasadowych i ziem alkalicznych reagują z wodą, tworząc wodorotlenki.
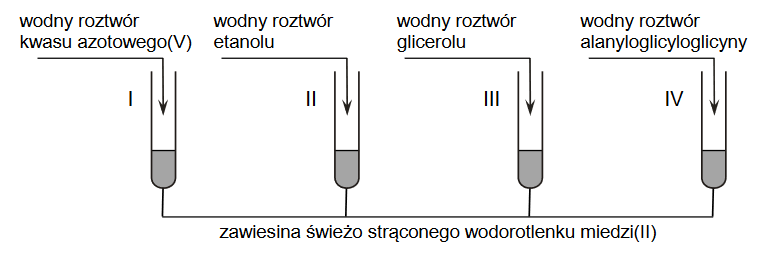
- Reakcja soli metalu z zasadą: Jeśli do roztworu soli metalu dodamy zasadę (czyli roztwór zawierający jony OH-), to w przypadku powstania nierozpuszczalnego wodorotlenku metalu, nastąpi jego wytrącenie z roztworu w postaci osadu.
Przykład: Reakcja sodu (Na) z wodą (H2O):
2Na + 2H2O → 2NaOH + H2↑
W tym przypadku powstaje wodorotlenek sodu (NaOH) i wodór.
Przykład: Reakcja tlenku wapnia (CaO) z wodą (H2O):
CaO + H2O → Ca(OH)2
Powstaje wodorotlenek wapnia (Ca(OH)2), znany również jako wapno gaszone.
Przykład: Reakcja chlorku żelaza(III) (FeCl3) z wodorotlenkiem sodu (NaOH):
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Powstaje nierozpuszczalny wodorotlenek żelaza(III) (Fe(OH)3), który osadza się na dnie naczynia, oraz chlorek sodu (NaCl).
Należy pamiętać, że reaktywność metali jest różna. Nie wszystkie metale reagują z wodą lub tlenkami w łatwy sposób. Dla metali mniej aktywnych chemicznie, reakcja z zasadą jest często jedyną skuteczną metodą otrzymywania wodorotlenków.
Wodorotlenki mają szerokie zastosowanie. Na przykład, wodorotlenek sodu (NaOH) jest używany w produkcji mydła, papieru i wielu innych chemikaliów. Wodorotlenek wapnia (Ca(OH)2), jak wspomniano, znany jako wapno gaszone, jest wykorzystywany w budownictwie do produkcji zapraw murarskich oraz do regulacji pH gleby w rolnictwie.