Kwasy Sprawdzian Chemia Nowej Ery 2 Odpowiedzi

Dziś przyjrzymy się zagadnieniu kwasy, które jest fundamentalnym tematem w chemii. Kwasy to związki chemiczne, które posiadają specyficzne właściwości i reaktywność. W podstawowym ujęciu, kwas to substancja, która w roztworze wodnym zwiększa stężenie jonów wodorowych (H+). Ten wzrost stężenia jonów H+ jest kluczowy dla ich charakterystycznych cech.
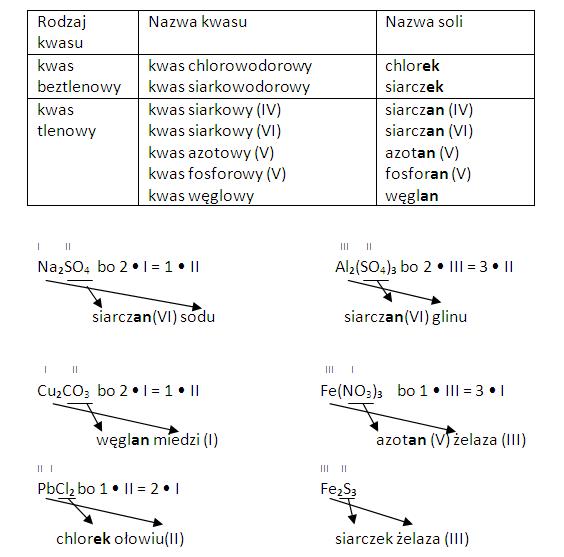
Istnieje kilka definicji kwasów, z których najczęściej używane w szkole są dwie: definicja Arrheniusa i definicja Brønsteda-Lowry'ego. Według Arrheniusa, kwas to substancja, która dysocjuje w wodzie, uwalniając jony H+. Klasycznym przykładem jest kwas solny (HCl), który w wodzie rozpada się na jony H+ i Cl-. Jest to reakcja, którą można łatwo zaobserwować w laboratorium i zrozumieć podstawowe zachowanie kwasu.
Definicja Brønsteda-Lowry'ego jest szersza. Według niej, kwas to cząsteczka lub jon, który może oddawać proton (czyli właśnie jon H+) innemu związkowi, który nazywamy zasadą. Oznacza to, że reakcje kwas-zasada nie muszą zachodzić w wodzie. Na przykład, kwas siarkowy (H2SO4) może oddać proton amoniakowi (NH3), tworząc jon siarczanowy (HSO4-) i jon amonowy (NH4+).
Kwasy mają charakterystyczny, kwaśny smak, choć nigdy nie należy próbować nieznanych substancji chemicznych! Często są również żrące, dlatego z substancjami tymi należy obchodzić się ostrożnie, stosując odpowiednie środki ochrony osobistej. Wskaźniki kwasowości, takie jak lakmus czy wskaźnik uniwersalny, zmieniają swoje zabarwienie w obecności kwasów, co pozwala nam określić ich obecność i stężenie. Na przykład, lakmus w środowisku kwaśnym przybiera kolor czerwony.
Praktyczne zastosowania kwasów są wszechobecne w naszym życiu. Kwas cytrynowy znajdziemy w owocach cytrusowych, gdzie nadaje im kwaśny smak i działa jako środek konserwujący. Kwas octowy jest głównym składnikiem octu spożywczego, używanego w kuchni do przyprawiania i konserwowania żywności. W przemyśle kwas siarkowy jest jednym z najważniejszych chemikaliów, wykorzystywanym do produkcji nawozów, tworzyw sztucznych i w procesach metalurgicznych.
Reakcje kwasów z metalami prowadzą do wydzielenia wodoru i powstania soli. Na przykład, kwas solny reaguje z cynkiem, tworząc chlorek cynku i gazowy wodór. Kwasy reagują również z wodorotlenkami (zasadami), tworząc sole i wodę – jest to tzw. reakcja zobojętniania. Ta reakcja jest bardzo ważna w neutralizacji nadmiaru kwasów, na przykład w przypadku problemów z trawieniem. Rozumienie tych podstawowych reakcji jest kluczowe do dalszego zgłębiania chemii.