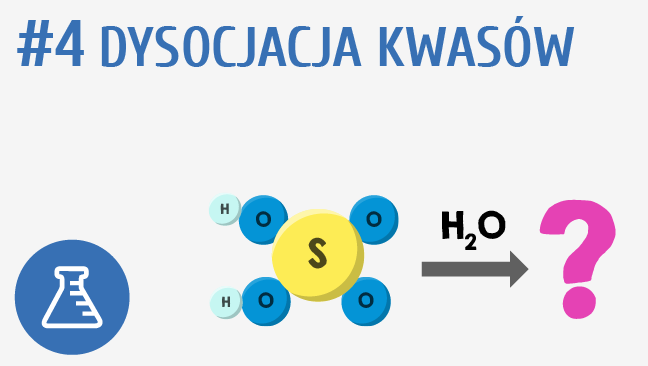
Dysocjacja Kwasu Octowego
Hej! Dziś porozmawiamy o dysocjacji kwasu octowego. Brzmi groźnie? Spokojnie, zaraz zobaczysz, że to nic trudnego.
Zacznijmy od początku. Co to w ogóle jest dysocjacja? Dysocjacja to proces rozpadu związku chemicznego na jony. Dzieje się to najczęściej pod wpływem wody.
Jony to atomy lub grupy atomów, które mają ładunek elektryczny. Mogą być dodatnie (kationy) lub ujemne (aniony). Pamiętaj o tym! To ważne.
A czym jest kwas octowy? To nic innego jak ocet, który masz w kuchni! Ocet jest roztworem kwasu octowego w wodzie. Jego wzór chemiczny to CH3COOH.
Kwas octowy jest kwasem karboksylowym. Kwasy karboksylowe to związki organiczne, które zawierają grupę karboksylową (-COOH). To właśnie ta grupa decyduje o kwasowych właściwościach kwasu octowego.
Teraz połączmy te informacje. Dysocjacja kwasu octowego to rozpad cząsteczek kwasu octowego na jony w wodzie. Ale nie wszystkie cząsteczki kwasu octowego ulegają dysocjacji. To bardzo ważne!
Kwas octowy jest słabym kwasem. Oznacza to, że tylko niewielka część jego cząsteczek rozpada się na jony w wodzie. Silne kwasy dysocjują prawie całkowicie.
Jak wygląda dysocjacja kwasu octowego? Cząsteczka kwasu octowego (CH3COOH) oddaje jon wodorowy (H+) cząsteczce wody (H2O). Powstaje jon octanowy (CH3COO-) i jon hydroniowy (H3O+).
Zapiszmy to równaniem chemicznym: CH3COOH + H2O ⇌ CH3COO- + H3O+. Zwróć uwagę na podwójną strzałkę! Oznacza to, że reakcja jest odwracalna.
Co to znaczy, że reakcja jest odwracalna? Oznacza to, że dysocjacja kwasu octowego zachodzi w obie strony. Część cząsteczek kwasu octowego rozpada się na jony, a część jonów łączy się z powrotem, tworząc cząsteczki kwasu octowego.
W roztworze kwasu octowego mamy więc mieszaninę cząsteczek kwasu octowego, jonów octanowych i jonów hydroniowych. Ale przeważają cząsteczki kwasu octowego, ponieważ jest on słabym kwasem.
Dlaczego to takie ważne? Ilość jonów hydroniowych (H3O+) w roztworze decyduje o jego kwasowości. Im więcej jonów hydroniowych, tym bardziej kwasowy jest roztwór.
W życiu codziennym dysocjację kwasu octowego wykorzystujemy na przykład w marynatach. Kwas octowy zakwasza potrawy, co pomaga je konserwować i nadaje im charakterystyczny smak.
Podsumowując: dysocjacja kwasu octowego to proces rozpadu cząsteczek octu na jony w wodzie. Kwas octowy jest słabym kwasem, więc dysocjuje tylko w niewielkim stopniu. Pamiętaj o tych podstawowych pojęciach, a zrozumiesz chemię łatwiej!