Co To Jest Wiązanie Kowalencyjne Spolaryzowane
Cześć! Zaczynamy naszą przygodę z wiązaniem kowalencyjnym spolaryzowanym. To brzmi skomplikowanie, prawda? Ale spokojnie, rozłożymy to na czynniki pierwsze, używając obrazowych przykładów.
Wyobraź sobie, że dwoje dzieci bawi się liną. Chcą przeciągnąć linę, ale jedno z nich jest silniejsze. Co się dzieje? Lina przesuwa się w stronę silniejszego dziecka. Podobnie dzieje się w wiązaniu kowalencyjnym spolaryzowanym.
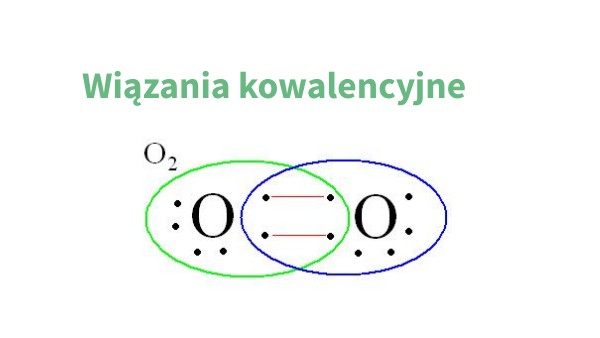
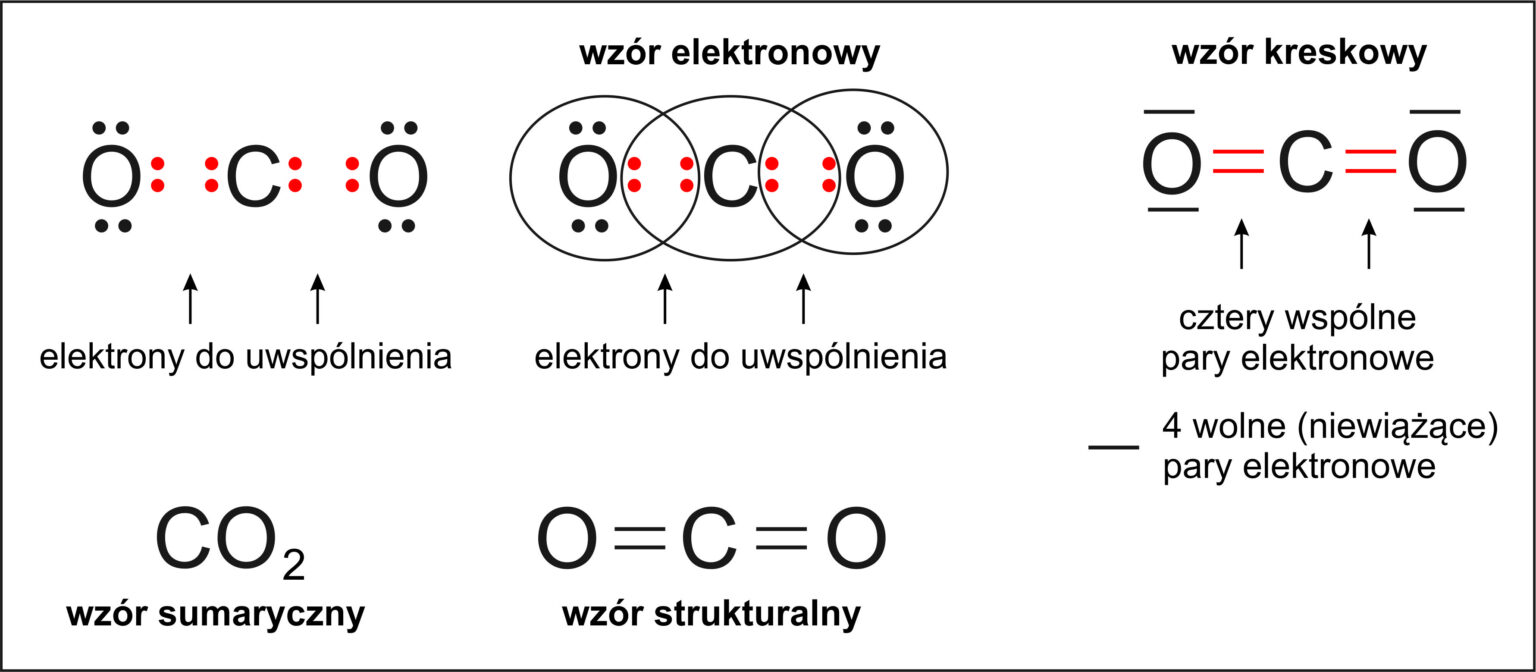
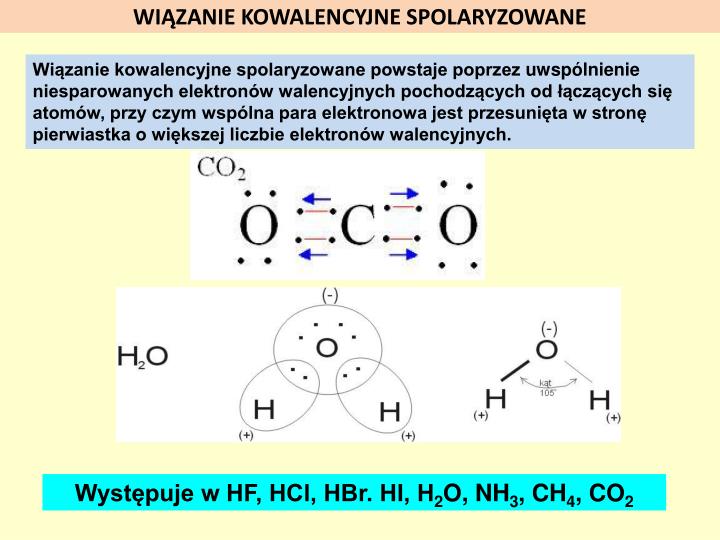
Wiązanie kowalencyjne to połączenie dwóch atomów, które dzielą się elektronami. Normalnie dzielą się po równo, tak jak dwoje dzieci o równej sile przeciąga linę. Ale co, jeśli jeden atom jest bardziej "chciwy" na elektrony niż drugi?
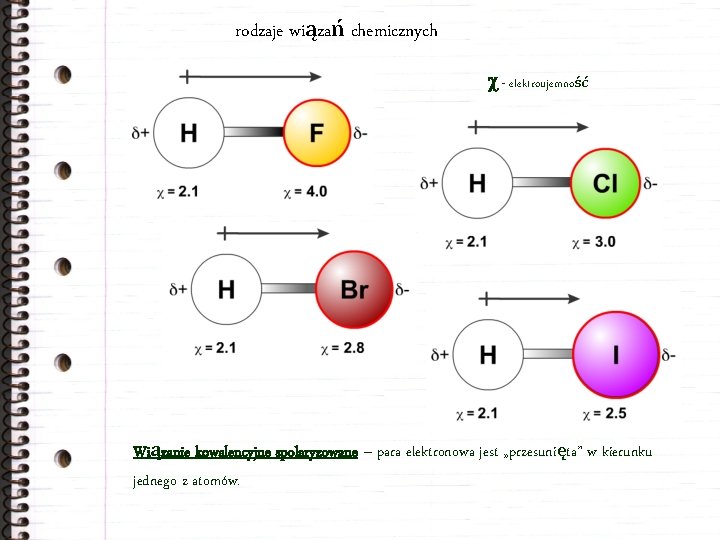
Mówimy wtedy o elektroujemności. Elektroujemność to miara tego, jak mocno atom przyciąga elektrony w wiązaniu. Atomy o wyższej elektroujemności "ciągną" elektrony mocniej. Pomyśl o tym jak o sile dziecka w naszym porównaniu.
W wiązaniu kowalencyjnym spolaryzowanym jeden z atomów ma wyższą elektroujemność niż drugi. To oznacza, że elektrony nie są dzielone równo. Bardziej elektroujemny atom przyciąga elektrony do siebie bardziej. To tak, jakby lina w zabawie była przesunięta w stronę silniejszego dziecka.
Konsekwencją tego jest, że atom o wyższej elektroujemności staje się lekko ujemny (ma więcej elektronów niż normalnie). Oznaczamy to symbolem δ- (delta minus). Atom o niższej elektroujemności staje się lekko dodatni (ma mniej elektronów niż normalnie). Oznaczamy to symbolem δ+ (delta plus). Powstaje więc coś w rodzaju małego magnesu, z jednym końcem lekko ujemnym i drugim lekko dodatnim.
Weźmy wodę (H2O) jako przykład. Tlen (O) jest znacznie bardziej elektroujemny niż wodór (H). Oznacza to, że tlen przyciąga elektrony z wiązań O-H bardziej do siebie. W rezultacie atom tlenu ma ładunek δ-, a każdy atom wodoru ma ładunek δ+. Dzięki temu woda jest cząsteczką polarną.
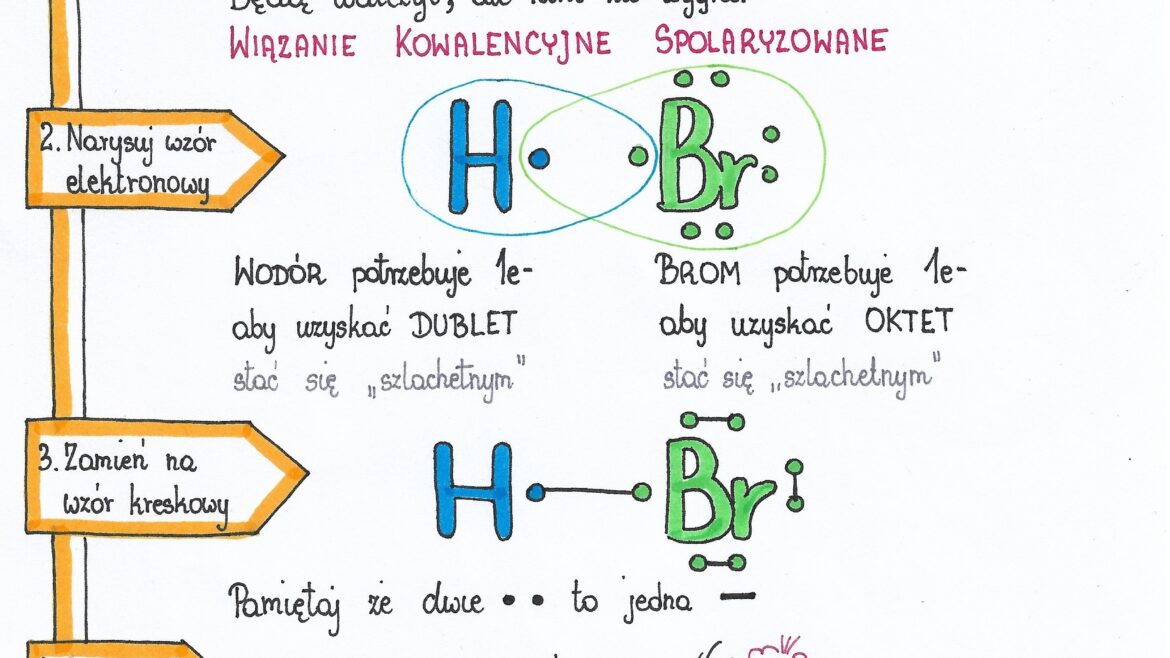
Inny przykład to chlorowodór (HCl). Chlor (Cl) jest bardziej elektroujemny niż wodór (H). Elektrony przesuwają się w stronę chloru. Chlor zyskuje ładunek δ-, a wodór δ+. Znowu mamy do czynienia z polarnym wiązaniem i polarną cząsteczką.
Jak rozpoznać, czy wiązanie jest spolaryzowane? Po pierwsze, musisz znać wartości elektroujemności atomów. Po drugie, jeśli różnica w elektroujemności jest znacząca (zazwyczaj powyżej 0.4), wiązanie będzie spolaryzowane. Pamiętaj, im większa różnica elektroujemności, tym bardziej spolaryzowane wiązanie.
Wiązania kowalencyjne spolaryzowane mają ogromne znaczenie w chemii i biologii. To one odpowiadają za właściwości wody, rozpuszczalność substancji i wiele innych procesów. Dzięki nim życie, jakie znamy, jest możliwe.
Podsumowując: Wiązanie kowalencyjne spolaryzowane powstaje, gdy atomy o różnej elektroujemności dzielą się elektronami nierówno. To tworzy cząsteczki z częściowymi ładunkami, czyli cząsteczki polarne. Pamiętaj o analogii z przeciąganiem liny – to pomoże Ci zapamiętać, który atom "ciągnie" elektrony mocniej!