Chemia Sprawdzian Sole 2 Gimnazjum Tabela Soli

Cześć, drodzy młodzi chemicy! Czy zbliża się Wasz sprawdzian z chemii poświęcony solom? Czujecie lekkie zdenerwowanie na myśl o wszystkich wzorach, nazwach i właściwościach? Doskonale Was rozumiemy! To zupełnie naturalne. Naszym celem jest pomóc Wam przejść przez ten sprawdzian pewnym krokiem, zrozumieć tajniki soli i sprawić, by nauka stała się łatwiejsza i bardziej przystępna. Ten artykuł jest stworzony specjalnie dla Was – uczniów drugich klas gimnazjum – którzy stają przed wyzwaniem opanowania tego zagadnienia.
Rozprawmy się ze Sprawdzianem z Soli – Krok po Kroku!
Zacznijmy od początku. Czym właściwie są sole? W świecie chemii sole to związki chemiczne, które powstają w wyniku reakcji kwasów z zasadami. Są one niezwykle powszechne w przyrodzie i mają ogromne znaczenie w naszym codziennym życiu. Od soli kuchennej, którą dodajemy do potraw, po minerały budujące naszą planetę – sole są wszędzie!
Dlaczego Sole są Tak Ważne na Sprawdzianie?
Nauczyciele często skupiają się na solach podczas sprawdzianów, ponieważ ich zrozumienie jest kluczowe do dalszej nauki chemii. Poznanie soli pozwala Wam lepiej pojąć takie zagadnienia jak:
- Reakcje chemiczne: Jak powstają i jak reagują sole?
- Właściwości substancji: Jakie cechy fizyczne i chemiczne posiadają sole?
- Zastosowania w życiu codziennym: Gdzie spotykamy sole i do czego ich używamy?
Ten sprawdzian to Wasza szansa, aby pokazać, że opanowaliście materiał i jesteście gotowi na kolejne wyzwania naukowe. Nie przejmujcie się, jeśli na początku wydaje się to skomplikowane. Z odpowiednim podejściem i naszym wsparciem, staniecie się ekspertami od soli!
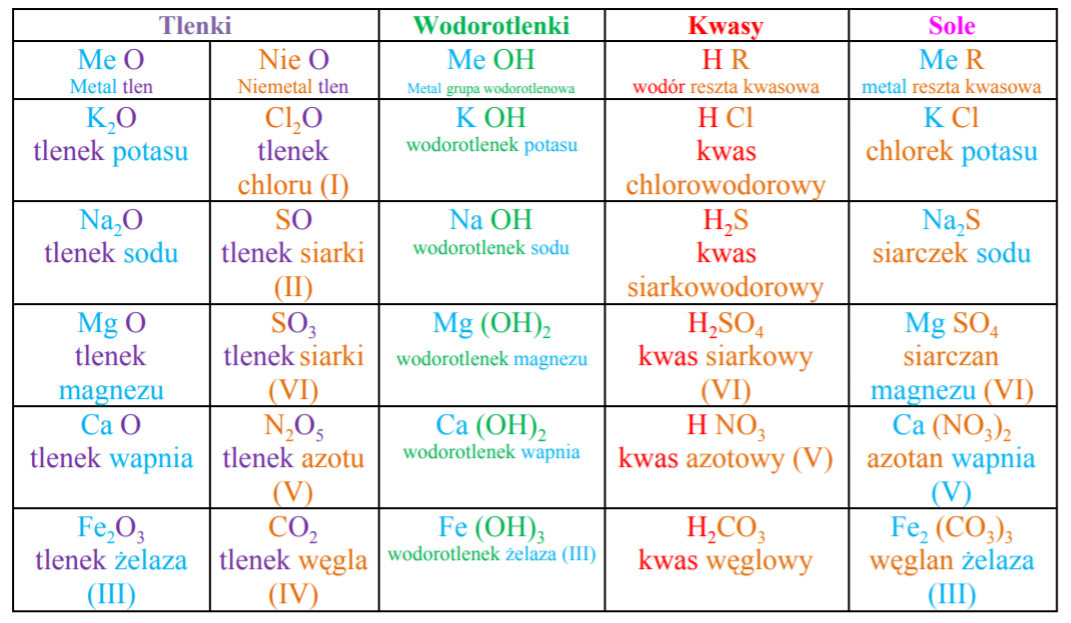
Tabela Soli – Wasz Niezawodny Przewodnik
Chcemy Wam dzisiaj przedstawić niezastąpione narzędzie w nauce o solach – Tabelę Soli. To nie jest zwykła lista wzorów. To kompendium wiedzy, które pomoże Wam uporządkować informacje i zrozumieć zależności. Tabela soli, którą dla Was przygotowaliśmy, zawiera:
- Nazwy systematyczne soli: Nauczyciecie się, jak poprawnie nazywać sole według zasad nomenklatury chemicznej.
- Wzory chemiczne: Zrozumicie, jak zapisać symbolicznie daną sól, uwzględniając pierwiastki wchodzące w jej skład i ich ilości.
- Kationy i aniony: Poznajcie budowę soli – składają się one z dodatnio naładowanych jonów (kationów) pochodzących od zasad oraz ujemnie naładowanych jonów (anionów) pochodzących od kwasów.
- Rozpuszczalność w wodzie: To niezwykle ważna informacja! Dowiecie się, czy dana sól rozpuszcza się w wodzie, czy też nie. To decyduje o wielu jej właściwościach i zastosowaniach.
- Przykładowe zastosowania: Zobaczycie, jak fascynujące i praktyczne są zastosowania soli w różnych dziedzinach życia.
Wyobraźcie sobie, że macie przed sobą mapę skarbów do świata soli. Tabela soli jest właśnie taką mapą. Zamiast błądzić w gąszczu informacji, macie jasny, uporządkowany przewodnik, który prowadzi Was prosto do celu – zrozumienia i sukcesu!
Jak Korzystać z Tabeli Soli? Praktyczne Wskazówki
Aby maksymalnie wykorzystać potencjał Tabeli Soli, proponujemy Wam następujące kroki:
- Zacznijcie od podstaw: Upewnijcie się, że rozumiecie, czym są kationy i aniony. To podstawa budowy każdej soli.
- Przeglądajcie po grupach: Skupcie się na jednym typie soli naraz, na przykład solach sodu, potasu czy wapnia. Zobaczcie, jak te same kationy łączą się z różnymi anionami.
- Zwracajcie uwagę na rozpuszczalność: To kluczowy element. Zapamiętajcie ogólne zasady rozpuszczalności (np. sole sodu, potasu i amonu są zazwyczaj rozpuszczalne).
- Łączcie teorię z praktyką: Postarajcie się znaleźć przykłady z życia codziennego dla poszczególnych soli. To sprawi, że nauka będzie bardziej zapamiętywalna.
- Regularnie powtarzajcie: Kluczem do sukcesu jest systematyczność. Wracajcie do tabeli, ćwiczcie nazewnictwo i wzory.
Pamiętajcie, że Tabela Soli to Wasz sojusznik. Nie traktujcie jej jak nudny podręcznik, ale jak interaktywne narzędzie, które pomaga Wam odkrywać fascynujący świat chemii.
Przykładowa Tabela Soli dla Uczniów Gimnazjum
Oto uproszczona Tabela Soli, która pomoże Wam w nauce. Skupiamy się tutaj na najczęściej pojawiających się solach na sprawdzianach w gimnazjum.
| Nazwa zwyczajowa / systematyczna | Wzór chemiczny | Kation | Anion | Rozpuszczalność w wodzie | Przykładowe zastosowania |
|---|---|---|---|---|---|
| Sól kuchenna / Chlorek sodu | NaCl | Na+ | Cl- | Rozpuszczalna | Przyprawa, konserwant, produkcja mydła, przemysł chemiczny. |
| Soda oczyszczona / Wodorowęglan sodu | NaHCO3 | Na+ | HCO3- | Rozpuszczalna | Środek spulchniający w pieczeniu, neutralizacja kwasów, kosmetyka. |
| Węglan sodu (soda kalcynowana) | Na2CO3 | Na+ | CO32- | Rozpuszczalny | Produkcja szkła, proszki do prania, zmiękczanie wody. |
| Siarczan magnezu (sól Epsom) | MgSO4 | Mg2+ | SO42- | Rozpuszczalny | Medycyna (leczenie), kosmetyka, nawozy. |
| Węglan wapnia | CaCO3 | Ca2+ | CO32- | Nierozpuszczalny (bardzo słabo rozpuszczalny) | Budownictwo (wapień, marmur), suplementy diety, pasta do zębów. |
| Azotan potasu (saletra potasowa) | KNO3 | K+ | NO3- | Rozpuszczalny | Nawozy, produkcja prochu strzelniczego, konserwant żywności. |
| Chlorek potasu | KCl | K+ | Cl- | Rozpuszczalny | Zamiennik soli kuchennej (dla osób z nadciśnieniem), nawozy, leki. |
| Siarczan miedzi(II) (niebieski witriol) | CuSO4 | Cu2+ | SO42- | Rozpuszczalny | Środek grzybobójczy w rolnictwie, galwanotechnika, barwnik. |
| Chlorek amonu | NH4Cl | NH4+ | Cl- | Rozpuszczalny | Przemysł metalowy (lutowanie), kosmetyka (szampony), leki. |
| Azotan srebra | AgNO3 | Ag+ | NO3- | Rozpuszczalny | Medycyna (środek antyseptyczny), fotografia, jubilerstwo. |
Uwaga: Ta tabela jest przykładem i nie zawiera wszystkich możliwych soli. Ważne jest, aby rozumieć zasady, na których bazuje, a nie tylko uczyć się na pamięć poszczególnych przykładów.
Jak Powstają Sole? Kluczowe Reakcje
Zrozumienie, jak powstają sole, jest niezwykle ważne. Pozwala Wam to przewidywać produkty reakcji. Oto najczęściej spotykane typy reakcji prowadzących do powstania soli:
- Reakcja kwasu z zasadą (neutralizacja): To klasyczna reakcja. Kwas reaguje z zasadą, tworząc sól i wodę. Przykład: Kwas solny (HCl) + Wodorotlenek sodu (NaOH) → Chlorek sodu (NaCl) + Woda (H2O).
- Reakcja kwasu z tlenkiem metalu: Tlenki metali są zasadowe. Reagują z kwasami, dając sól i wodę. Przykład: Kwas siarkowy(VI) (H2SO4) + Tlenek miedzi(II) (CuO) → Siarczan miedzi(II) (CuSO4) + Woda (H2O).
- Reakcja zasady z tlenkiem niemetalu: Tlenki niemetali są kwasowe. Reagują z zasadami, dając sól i wodę. Przykład: Wodorotlenek wapnia (Ca(OH)2) + Dwutlenek węgla (CO2) → Węglan wapnia (CaCO3) + Woda (H2O).
- Reakcja kwasu z solą: Silniejszy kwas może wypierać słabszy kwas z jego soli. Przykład: Siarczan(VI) sodu (Na2SO4) + Kwas solny (HCl) → Chlorek sodu (NaCl) + Kwas siarkowy(VI) (H2SO4) - ta reakcja nie zachodzi, gdyby kwas solny był silniejszy niż siarkowy! Pamiętajcie o tym! (W tym przypadku, jeśli reakcja zachodzi, to na odwrót, silniejszy kwas wypiera słabszy. Poprawny przykład to: Chlorek baru (BaCl2) + Kwas siarkowy(VI) (H2SO4) → Siarczan baru (BaSO4 osad) + Kwas solny (HCl)).
- Reakcja między solami: Zachodzi, gdy powstaje osad, gaz lub woda. To reakcje metatezy (wymiany jonów). Przykład: Chlorek baru (BaCl2) + Siarczan sodu (Na2SO4) → Siarczan baru (BaSO4 osad) + Chlorek sodu (NaCl).
Zapamiętajcie te schematy reakcji. Pozwolą Wam one rozwiązać wiele zadań na sprawdzianie.
Jak Przygotować Się do Sprawdzianu? Nasze Rady
Teraz, gdy już wiecie, czym są sole i jak ważna jest Tabela Soli, czas na konkretne wskazówki dotyczące przygotowania:
- Nauczcie się nazewnictwa: Poćwiczcie tworzenie nazw soli od nazw kwasów i zasad. Zapamiętajcie końcówki, np. -an dla soli kwasów tlenowych, -ek dla soli kwasów beztlenowych.
- Opanujcie wzory: Ćwiczcie pisanie wzorów chemicznych, pamiętając o wartościachowości pierwiastków. Tabela soli jest tutaj nieoceniona.
- Zrozumcie rozpuszczalność: To jeden z najważniejszych elementów sprawdzianu. Uczcie się reguł rozpuszczalności i potrafcie zastosować je w praktyce.
- Ćwiczcie reakcje: Rozwiążcie jak najwięcej zadań z układaniem równań reakcji chemicznych. Praktyka czyni mistrza!
- Wykorzystajcie Tabelę Soli: Twórzcie własne notatki, podkreślajcie kluczowe informacje, rysujcie schematy.
- Pracujcie w grupach: Tłumaczenie materiału kolegom pomaga utrwalić wiedzę.
- Nie bójcie się pytać: Jeśli czegoś nie rozumiecie, zwróćcie się do nauczyciela lub starszych kolegów.
Pamiętajcie, że sprawdzian to nie koniec świata. To naturalny etap nauki, który pozwala Wam sprawdzić, co już umiecie. Z pozytywnym nastawieniem i odpowiednim przygotowaniem, poradzicie sobie doskonale!
Podsumowanie: Pewnym Krokiem do Sukcesu
Drogi Uczniu, mamy nadzieję, że ten artykuł rozwiał Wasze wątpliwości i dostarczył cennych narzędzi do nauki. Sole mogą wydawać się trudne, ale z Tabelą Soli i naszymi wskazówkami, staniecie się ekspertami. Pamiętajcie, że chemia to fascynująca przygoda, a poznawanie jej tajników otwiera przed Wami nowe możliwości. Życzymy Wam powodzenia na sprawdzianie – jesteśmy pewni, że poradzicie sobie świetnie!